题目内容
(1)只用一种试剂即可除去少量杂质和鉴别物质。将其填在空格处。
| 编号 | 物质 | 试剂名称或化学式 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:SiO2(CaCO3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:Na2CO3 Na2SiO3 Na2SO3溶液 | |
| ⑤ | 鉴别:(NH4)2SO4 NH4C1 Na2SO4溶液 | |
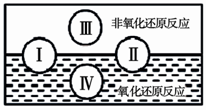
(2)氧化还原是常见的反应类型,根据信息回答以下问题: “四种基本反应类型与氧化还原反应的关系”也可用下图表达。其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,其中水作为 剂。(填氧化剂、还原剂等)
(3)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是 。
(1)①二氧化碳 ②盐酸 ③ 铁屑 ④ 盐酸 ⑤ 氢氧化钡溶液
(2)分解; III方程式合理即可.IV方程式合理即可
与金属反应水为氧化剂。与氟反应水为还原剂。与氯气反应水既不是氧化剂也不是还原剂。
(3)(2分)SO2+C12+2H2O===4H++SO42-+2Cl-
解析试题分析:(1)①Na2CO3与CO2、H2O反应生成NaHCO3,所以加入CO2可除去杂质Na2CO3。
②盐酸与CaCO3反应生成CaCl2、CO2和H2O,所以加入盐酸可除去CaCO3。
③Fe与FeCl3反应生成FeCl2,所以加入Fe可除去FeCl3。
④加入盐酸生成无色无味气体的溶液是Na2CO3,生成无色刺激性气味气体的溶液是Na2SO3,生成白色沉淀的溶液是Na2SiO3。
⑤加入Ba(OH)2溶液,只生成白色沉淀的溶液是Na2SO4,只生成刺激性气味气体的溶液是NH4Cl,既生成白色沉淀,也生成刺激性气味气体的溶液是(NH4)2SO4.
(2)化合反应与分解反应部分属于氧化反应,部分属于非氧化反应;类型Ⅲ为复分解反应,生成H2O的反应都可以,如酸碱中和反应:HCl+NaOH=NaCl+H2O;反应类型Ⅳ是置换反应,有H2O参加反应如:2Na+2H2O=2NaOH+H2↑,水为氧化剂。
(3)Cl2与SO2、H2O反应生成H2SO4和HCl,离子方程式为:SO2+C12+2H2O===4H++SO42-+2Cl-
考点:本题考查物质的鉴别和除杂、基本反应类型与氧化还原反应、离子方程式的书写。

分类法是研究化学的一种重要方法,下列乙中的物质与甲的分类关系匹配的是
| 选项 | 甲 | 乙 |
| A | 干燥剂 | 浓硫酸、石灰石、无水氯化钙 |
| B | 弱电解质 | 冰醋酸、氨、水 |
| C | 空气质量检测物质 | 氮氧化物、二氧化硫、PM2.5 |
| D | 酸性氧化物 | 三氧化硫、一氧化氮、二氧化硅 |
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下表各组归类
| 序号 | 分类标准 | 归类 |
| A | FeSO4、NO2、MnO2、NaClO、Cu3P、Na2O2 | H2SO3 |
| B | CH3COOH、HOOC—COOH、HClO、H2S | HF |
| C | 复分解反应、电解反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、NH3·H2O | NH4HCO3 |
(1)A中分类标准是_____________________,H2SO3________(填“是”或“否”)可归为此类。
(2)B中分类标准是_________________________,HF________(填“是”或“否”)可归为此类。
(3)C中分类标准是__________________,焰色反应属于________变化。
(4)D中分类标准是__________________,NH4HCO3________(填“是”或“否”)可归为此类。
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 KNO3溶液:Mg2+、Fe3+、Cl-、SO42- |
| B.无色透明的溶液:Cu2+、NH4+、NO3-、CO32- |
| C.使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- |
| D.水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、NH4+、SO42-、NO3- |
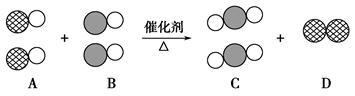
 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题: