题目内容
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol?L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 ,配制过程中除需用FeCl3固体、蒸馏水外,还需要的试剂有 。将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为 ,此液体具有的性质是 (填字母)。
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。
①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是 (填化学式)。
②已知:3Fe(s)+2O2(g)=Fe3O4(s) △H=?1118 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) △H=?1675.7 kJ·mol-1
则铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
。
(1)100mL容量瓶、玻璃棒 盐酸 Fe3++3H2O=Fe(OH)3(胶体)+3H+ a、d
(2)①Al、Al2O3 ②8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H=?3348.8 kJ·mol-1
解析试题分析:(2)①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,故一定有铝剩余,故除铁外Al、Al2O3②由盖斯定律可得 8Al(s)+3Fe3O4(s)= 4Al2O3(s)+9Fe(s) △H=?3348.8 kJ·mol-1
考点:考查反应热计算、盖斯定律、溶液配制、胶体等相关知识。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案(1)只用一种试剂即可除去少量杂质和鉴别物质。将其填在空格处。
| 编号 | 物质 | 试剂名称或化学式 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:SiO2(CaCO3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:Na2CO3 Na2SiO3 Na2SO3溶液 | |
| ⑤ | 鉴别:(NH4)2SO4 NH4C1 Na2SO4溶液 | |
(2)氧化还原是常见的反应类型,根据信息回答以下问题: “四种基本反应类型与氧化还原反应的关系”也可用下图表达。其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,其中水作为 剂。(填氧化剂、还原剂等)

(3)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是 。
对牙膏的探究要用到许多化学知识。
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别。
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) | | | |
(2)根据你的推测,牙膏摩擦剂的溶解性是________________________
(填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:
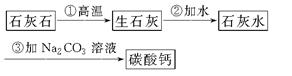
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①________________________________________________;
②________________________________________________;
③________________________________________________。
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石―→
你设计的方案的优点为:________________________________。
(5)检验牙膏中是否含有碳酸钙的实验方法是:__________________。
现有下列4组物质:
| A.CaO、MgO、CO2、CuO | B.H2、Cl2、N2、Cu |
| C.O2、Fe、Cu、Zn | D.HCl、H2O、H2SO4、HNO3 |
| | A组 | B组 | C组 | D组 |
| 分类标准 | 金属氧化物 | | 金属单质 | |
| 不属于该类别的物质 | | Cu | | H2O |
(2)若上表中的4种物质相互作用可生成一种新物质——碱式碳酸铜[Cu2(OH)2CO3],写出该反应的化学方程式 。
在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
| A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32— |
| C.在含Fe3+、H+、NH4+的溶液中逐滴加入烧碱溶液:Fe3+、NH4+、H+ |
| D.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32— |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O ="=" Cu(OH)2↓+ 2H+ |
| C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH- = NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O |