题目内容
4.用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下: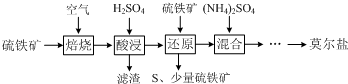
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是pH过高时铁元素将沉淀导致产率降低,写出“还原”时反应Ⅱ的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7.计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
分析 硫铁矿(主要含FeS2、SiO2等)在空气中焙烧,得二氧化硫气体和氧化铁、二氧化硅等固体,加硫酸溶解,过滤除去二氧化硅,得硫酸铁溶液,硫酸铁溶液中再加入硫铁矿,FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有S、硫铁矿,滤液中主要含有硫酸亚铁的混合溶液,向混合溶液中加入硫酸铵,经过蒸发浓缩降温结晶,过滤,洗涤,干燥可得莫尔盐,据此答题.
解答 解:硫铁矿(主要含FeS2、SiO2等)在空气中焙烧,得二氧化硫气体和氧化铁、二氧化硅等固体,加硫酸溶解,过滤除去二氧化硅,得硫酸铁溶液,硫酸铁溶液中再加入硫铁矿,FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有S、硫铁矿,滤液中主要含有硫酸亚铁的混合溶液,向混合溶液中加入硫酸铵,经过蒸发浓缩降温结晶,过滤,洗涤,干燥可得莫尔盐,
(1)根据上面的分析可知,“还原”时,铁离子做氧化剂,如果pH过高时铁元素将沉淀导致产率降低,“还原”时FeS2把铁离子还原为Fe2+,同时生成S沉淀,所以反应Ⅱ的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,
故答案为:pH过高时铁元素将沉淀导致产率降低;FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(2)根据表中数据可知,反应后硫酸根的浓度比反应前增加了3.50mol•L-1-3.20mol•L-1=0.3mol•L-1,根据反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+可知,反应中消耗Fe3+的物质的量为2.1mol,生成的Fe2+物质的量为2.25mol,由于Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7,Ⅰ中消耗的铁离子的物质的量为0.6mol,根据反应2Fe3++FeS2=2S↓+3Fe2+可知,生成Fe2+物质的量为0.9mol,所以反应后溶液中Fe2+物质的量为2.25mol+0.9mol+0.15mol=3.30mol,
故答案为:3.30;
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份,一份加入足量的BaCl2溶液,得到白色沉淀硫酸钡的质量为13.98g,其物质的量为$\frac{13.98g}{233g/mol}$=0.06mol,所以n(SO42-)=0.06mol,
另一份用0.2000mol•L-1K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL,根据题意,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol•L-1×0.025L,
所以n(Fe2+)=0.005 mol×6=0.03mol,
根据电荷守恒:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,
n(H2O)=$\frac{\frac{23.52g}{2}-0.06mol×96g/mol-0.03mol×56g/mol-0.06mol×18g/mol}{18g/mol}$=0.18 mol,
所以n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0 06 mol:0 03 mol:0 06mol:0 18 mol=2:1:2:6,
所以莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
故答案为:(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O].
点评 本题以制备莫尔盐为知识背景,难度中等,清楚工艺流程原理以及学会物质分子式确定的计算是解题的关键,考查学生的计算能力以及分析和解决问题的能力,综合性较强.

| A. | NO | B. | NO2 | C. | N2O | D. | N2O3 |
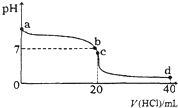 室温下,将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.下列有关说法不正确的是( )| A. | a点的pH>7,但Kw仍为1.0×10-14 | |
| B. | b点所示溶液中C(Cl-)=C(NH4+) | |
| C. | C点溶液pH<7,其原因是NH4++H2O?NH3•H2O+H+ | |
| D. | d点所示溶液中离子浓度由大到小的排序是:c(Cl-)>C(NH4+)>C(H+)>C(OH-) |
| A. | 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)═2Fe(OH)3+3H2 | |
| B. | 向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
| 选项 | 操作或现象 | 实验目的 |
| A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
| B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
| D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 熔点低 | B. | 密度小 | C. | 硬度小 | D. | 化学性质活泼 |
| A. | 石墨转化为金刚石 | |
| B. | Na2O溶于水 | |
| C. | NaCl熔化 | |
| D. | NaOH溶液与盐酸反应生成NaCl和H2O |
 ;
;