题目内容
13.通过对金属钠与水反应现象的观察,不能分析得出的结论是( )| A. | 熔点低 | B. | 密度小 | C. | 硬度小 | D. | 化学性质活泼 |
分析 根据钠与水反应现象分析判断.
A、钠熔化成闪亮的小球.
B、钠浮在水面上.
C、钠与水反应不涉及硬度问题.
D、钠与水剧烈反应置换出氢气.
解答 解:A、钠与水反应放出的热能使本身熔化成闪亮的小球,说明熔点低,故A正确;
B、钠浮在水面上,说明密度比水小,故B正确;
C、钠与水反应不涉及硬度实验,无法验证其硬度,故C错误;
D、钠与水剧烈反应置换出氢气,说明金属钠化学性质活泼,故D正确.
故选:C.
点评 本题考查钠的化学性质,题目难度不大,根据反应的实验现象推断可能具有的性质,注意基础知识的积累.

练习册系列答案
相关题目
4.用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
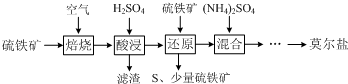
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是pH过高时铁元素将沉淀导致产率降低,写出“还原”时反应Ⅱ的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7.计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份.一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol•L-1K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL.试确定莫尔盐的化学式(请给出计算过程).

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是pH过高时铁元素将沉淀导致产率降低,写出“还原”时反应Ⅱ的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7.计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
8.证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是( )
| A. | 加入盐酸 | B. | 加入Ba(OH)2溶液 | C. | 测定溶液的pH值 | D. | 加入品红溶液 |
18.等物质的量的下列烃,分别完全燃烧,消耗氧气最少的是( )
| A. | 甲烷 | B. | 甲苯 | C. | 乙炔 | D. | 乙烷 |
5.入冬以来,东北各地陆续出现大范围的雾霾天气,主要原因是由于大气中PM2.5含量升高所造成的,PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的颗粒物.其中PM2.5的主要来源与汽车排放的尾气有关.下列有关叙述正确的是( )
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 将直径等于2.5微米的颗粒物分散于水即成为胶体 | |
| C. | 雾具有丁达尔现象 | |
| D. | 增加使用汽车,提高交通效率可缓解雾霾天气的产生 |
2.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将20 g NaOH 溶解在500mL 水中 | |
| B. | 将22.4 L HCl 气体溶于水配成1 L 溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9 L 水中 | |
| D. | 将10 g NaOH 溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250 mL |
3.M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是( )
| A. | 148 g•mol-1 | B. | 24 g•mol-1 | C. | 74 g•mol-1 | D. | 40 g•mol-1 |