题目内容
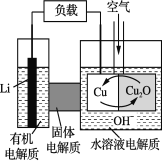
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O + 3e-=Fe(OH)3+5OH-
C. 放电时每转移3mol电子,正极有1mol K2FeO4被还原
D. 放电时正极附近溶液的pH不变
【答案】D
【解析】
A、放电时,Zn作负极,被氧化,由总反应可得,生成Zn(OH)2,电解质溶液呈碱性,所以电极反应式为Zn-2e-+2OH-=Zn(OH)2,A正确;
B、放电时,K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,B正确;
C、放电时,K2FeO4为电池的正极,Fe的化合价由+6价降为+3价,则每转移3mol电子,正极有1molK2FeO4被还原,C正确;
D、放电时,K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,正极生成OH-,溶液碱性增强,pH增大,D错误。
答案选D。

 寒假乐园北京教育出版社系列答案
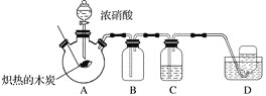
寒假乐园北京教育出版社系列答案【题目】根据下列实验现象,所得结论正确的是( )
实验 | 实验现象 | 结论 | |
A |
| 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B |
| 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C |
| 左边烧杯中无明显变化,右边烧杯中澄清石灰水变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
D |
| 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. AB. BC. CD. D