题目内容
【题目】为了测定某有机物A的结构,进行如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水,
②用质谱仪测定其相对分子质量,得到如图所示的质谱图。
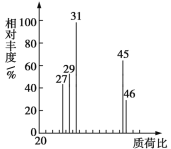
试回答下列问题:
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)能否根据A的实验式确定其分子式?____(填“能”或“不能”,并对应回答后面问题)。若能,则A的分子式是________,若不能,请说明原因:_________________。
【答案】46 C2H6O 能 C2H6O 不用填写
【解析】
(1)根据质荷比可以知道,有机物A的相对分子质量为46;
(2)根据n=![]() 计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素;若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素;若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)根据有机物的最简式中H原子是否已经饱和,来判定实验式与分子式关系。
(1)根据质荷比可以知道,有机物A的相对分子质量为46;
(2) 2.3g有机物燃烧生成生成0.1mol CO2和2.7g水,则n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)=![]() =0.15mol,m(H)=2×0.15mol×1g/mol=0.3g,则m(H)+m(C)=1.2+0.3=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=
=0.15mol,m(H)=2×0.15mol×1g/mol=0.3g,则m(H)+m(C)=1.2+0.3=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=![]() =0.05mol,n(C): n(H): n(O)=0.1:0.3:0.05=2:6:1,即该有机物最简式为C2H6O;
=0.05mol,n(C): n(H): n(O)=0.1:0.3:0.05=2:6:1,即该有机物最简式为C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和,所以该有机物最简式即为其分子式。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案