题目内容
(9分)某温度(t ℃)时,水的离子积为KW =1×10-13,则该温度____ 25 ℃(选填“>”“<”“=”),其理由是________________________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
(1)若所得混合溶液为中性,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____ 。(用c(Na+)等表示)
(2)若所得混合液的pH=2,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____ 。(用c(Na+)等表示)
(1)若所得混合溶液为中性,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____ 。(用c(Na+)等表示)
(2)若所得混合液的pH=2,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____ 。(用c(Na+)等表示)
>(1分) 25 ℃时水的KW=1×10-14(小于1×10-13),水的电离是吸热的,温度升高,KW增大(2分)
(1)10∶1 (1分) c(Na+)>c(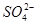 )>c(H+)=c(OH-)(2分)
)>c(H+)=c(OH-)(2分)
(2)9∶2 (1分) c(H+)>c(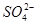 )>c(Na+)>c(OH-)(2分)
)>c(Na+)>c(OH-)(2分)
(1)10∶1 (1分) c(Na+)>c(
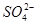 )>c(H+)=c(OH-)(2分)
)>c(H+)=c(OH-)(2分)(2)9∶2 (1分) c(H+)>c(
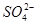 )>c(Na+)>c(OH-)(2分)
)>c(Na+)>c(OH-)(2分)25 ℃时,水的离子积为KW =1×10-14, KW (t ℃)=1×10-13>KW(25 ℃),且水的电离是吸热的,故说明t>25 ℃(升温,水的电离平衡正向移动,KW增大);
(1)“此温度下pH=11的苛性钠溶液”C(OH-)="0.01" mol·L-1,
“pH=1的稀硫酸”C(H+)="0.1" mol·L-1,
若所得混合溶液为中性,则两者恰好完全反应,即: OH- + H+ = H2O
1 1
0.01a 0.1b
即0.01a=0.1b,得:a∶b =10∶1;
反应后,变为Na2SO4溶液:Na2SO4=2Na+ + SO42-,则:c(Na+)>c(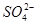 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
(2)若所得混合液的pH=2,则反应后剩余酸,且C余(H+)="0.01" mol·L-1,0.1b-0.01a=0.01(a+b),求解,得:a∶b =9∶2;
反应后,变为H2SO4、Na2SO4溶液:C余(H+)="0.01" mol·L-1,
反应前后,SO42-守恒,则C后(SO42-)="0.05b/(a+b)=0.009" mol·L-1,
反应前后,Na+守恒,则C后(Na+)="0.01a/(a+b)=0.0082" mol·L-1,
c(OH-)=1.0×10-11 mol·L-1,故c(H+)>c(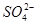 )>c(Na+)>c(OH-)
)>c(Na+)>c(OH-)
(1)“此温度下pH=11的苛性钠溶液”C(OH-)="0.01" mol·L-1,
“pH=1的稀硫酸”C(H+)="0.1" mol·L-1,
若所得混合溶液为中性,则两者恰好完全反应,即: OH- + H+ = H2O
1 1
0.01a 0.1b
即0.01a=0.1b,得:a∶b =10∶1;
反应后,变为Na2SO4溶液:Na2SO4=2Na+ + SO42-,则:c(Na+)>c(
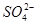 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)(2)若所得混合液的pH=2,则反应后剩余酸,且C余(H+)="0.01" mol·L-1,0.1b-0.01a=0.01(a+b),求解,得:a∶b =9∶2;
反应后,变为H2SO4、Na2SO4溶液:C余(H+)="0.01" mol·L-1,
反应前后,SO42-守恒,则C后(SO42-)="0.05b/(a+b)=0.009" mol·L-1,
反应前后,Na+守恒,则C后(Na+)="0.01a/(a+b)=0.0082" mol·L-1,
c(OH-)=1.0×10-11 mol·L-1,故c(H+)>c(
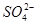 )>c(Na+)>c(OH-)
)>c(Na+)>c(OH-)
练习册系列答案
相关题目
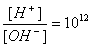 ,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
,将两种溶液等体积混合后,溶液中离子浓度关系正确的是