题目内容
实验测得在常温下0.1mol·L-1某一元碱(BOH)pH≠13,0.1 mol·L-1的某一元酸(HA)溶液中,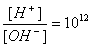 ,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
A.C(A-)>C(B+)>C(H+)>C(OH-) B.C(B+)>C(A-)>C(H+)>C(OH-)
C.C(B+)>C(A-)>C(OH-)=C(H+) D.C(A-)>C(B+)>C(OH-) >C(H+)
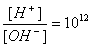 ,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
,将两种溶液等体积混合后,溶液中离子浓度关系正确的是A.C(A-)>C(B+)>C(H+)>C(OH-) B.C(B+)>C(A-)>C(H+)>C(OH-)
C.C(B+)>C(A-)>C(OH-)=C(H+) D.C(A-)>C(B+)>C(OH-) >C(H+)
A
在常温下0.1mol·L-1某一元碱(BOH)pH≠13,什么该碱不是强碱。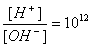 ,所以根据水的离子积常数可计算出氢离子浓度为0.1mol/,所以酸是强酸。二者等体积混合,恰好反应生成强酸弱碱盐BA,B+水解显酸性,所以选项A是正确的,答案选A。
,所以根据水的离子积常数可计算出氢离子浓度为0.1mol/,所以酸是强酸。二者等体积混合,恰好反应生成强酸弱碱盐BA,B+水解显酸性,所以选项A是正确的,答案选A。
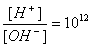 ,所以根据水的离子积常数可计算出氢离子浓度为0.1mol/,所以酸是强酸。二者等体积混合,恰好反应生成强酸弱碱盐BA,B+水解显酸性,所以选项A是正确的,答案选A。
,所以根据水的离子积常数可计算出氢离子浓度为0.1mol/,所以酸是强酸。二者等体积混合,恰好反应生成强酸弱碱盐BA,B+水解显酸性,所以选项A是正确的,答案选A。
练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目

 SO32―+2I―+4H+
SO32―+2I―+4H+