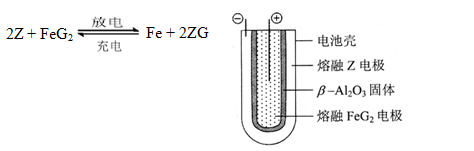
题目内容
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的是 (填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为 ,元素②与⑨形成的18e-化合物的电子式 ;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有 ;
(4)比较元素⑦⑧形成的气态氢化物的稳定性: > (用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式 。
(6)元素④和③形成的化合物属于 化合物,用电子式表示其形成过程 。
(1)③;(2)H—O—Cl; H∶O∶O∶H ;(3)离子键和共价键
(4)HCl> H2S。(5)Al2O3+2OH-=2AlO2-+H2O (6)离子 电子式形成过程
解析试题分析:(1)在同一周期的元素中,元素的原子序数越大,元素的非金属性越强,在不同周期的元素中,元素的原子核外的电子层数越少,元素的非金属性越强。因此在这些元素中非金属性最强的是③F元素。(2)元素O、Cl、H三元素以原子个数比1:1:1形成的化合物HClO的结构式为H—O—Cl。元素O、H形成的18e-化合物H2O2的电子式为 。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为:
。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为: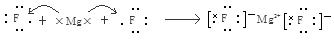 。
。
考点:考查元素及化合物的推断、元素的非金属性的比较、物质的电子式、结构式、离子方程式的书写、用电子式表示物质的形成过程的知识。

 阅读快车系列答案
阅读快车系列答案A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
(1)元素D在周期表中的位置为 。
(2)C与B形成原子个数比为1∶1的化合物中,含有的化学键类型为 。
(3)化合物甲、乙是由A、B、C、D四种元素中的三种组成的强电解质,且两种物质水溶液均显碱性。若甲能抑制水的电离,乙能促进水的电离,则化合物甲的电子式为 ;乙的化学式是 。
(4)以E构成的单质为Y极,碳棒为X极,在6 mol/L的NaOH溶液中进行电解,制取高效净水剂Na2YO4(溶液呈紫红色)。其装置如图。电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清。Y极发生的电极反应为:4OH--4e-
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。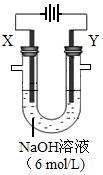
(5)Se是人体必备的微量元素,与B、D同一主族。Se的原子序数为34,且B、D、Se元素气态单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+ 29.7 kJ/mol b.-20.6 kJ/mol c.-241.8 kJ/mol
表示生成1 mol H2Se的反应热是 (填序号);依据是: 。
下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
| W | X | Y |
| | | Z |
请回答下列问题:
(1)Z的元素符号是 ,写出Z的原子结构示意图: 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为 。
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
| 1 | | |
| 2 | | |
(4)由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式: 。
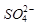 的空间构型为_____________,
的空间构型为_____________,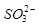 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。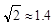 ,列式并计算结果)。
,列式并计算结果)。