题目内容
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
(1)SO3
(2)Cl HClO、HClO2、HClO3、HClO4(任写3种即可)
(3)直线形
(4)共价键 原子晶体
(5)D的最高价氧化物是CO2,X的最高价氧化物是SiO2,前者比后者的熔点低。因为前者为分子晶体,由分子间作用力结合,而后者为原子晶体,由共价键结合,共价键强度大于分子间作用力。
解析

练习册系列答案
相关题目
I.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同周期,也不同族。X原子最外层电子数是核外电子层数的三倍,Y的最高价与最低价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表第 周期,第 族;
N元素位于元素周期表第 周期,第 族。
(2)请写出下列反应的离子方程式:
N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示)
(4)请将X、Z、M、N元素原子半径从大到小排序:

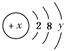 ,试回答:
,试回答:
