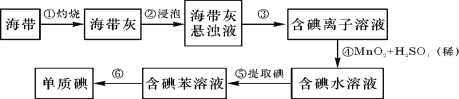
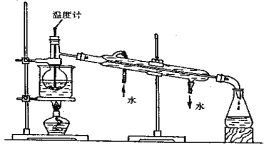
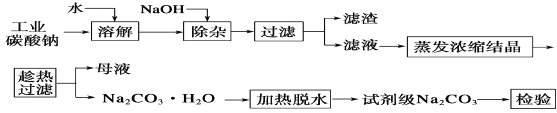
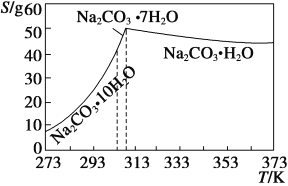
��Ŀ����
����Ŀ����50 mL NaOH��Һ����������ͨ��һ������CO2�����ȡ����Һ10 mL����ϡ����100 mL�������ϡ�ͺ����Һ����μ���0.1 mol��L-1��HCl��Һ������CO2������������״��������������������֮��Ĺ�ϵ����ͼ��ʾ��
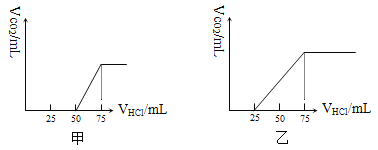
��1������Һ�е�������_____________�������ʵ���֮��Ϊ__________________��
��2������Һ�е�������_____________���ڱ�״��������CO2��������Ϊ________��
��3��ԭNaOH��Һ�����ʵ���Ũ��Ϊ ��
���𰸡���1��NaOH��Na2CO3��2�֣� 1:1��2�֣�
��2��Na2CO3��NaHCO3 ��2�֣� 112ml��2�֣���3��0.75 mol/L��1�֣�
��������
�����������1��������CO2����ʱ��������ӦNaHCO3+HCl=NaCl+H2O+CO2������ͼ��֪������CO2�������������HClΪ75mL����������̼��NaOH��Ӧ����Һ��ֻ��Na2CO3����Na2CO3+HCl=NaHCO3+NaCl��֪����Na2CO3ת��ΪNaHCO3Ӧ����HClΪ25mL����ͼ���п�ʼ����CO2����ʱ����HCl���Ϊ50mL��˵���ýλ�������Ӧ��NaOH+HCl=NaCl+H2O����Һ������ΪNaOH��Na2CO3���к�NaOH����HCl�����Ϊ50mL��25mL=25mL���ɷ���ʽ��֪NaHCO3��Na2CO3�����ʵ���֮�ȵ����������̷ֱ�������������֮�ȣ���NaOH��Na2CO3�����ʵ���֮��=25mL��25mL=1��1��Ũ��֮����1��1��
��2�����еڶ������ĵ�����࣬��˵����Һ�е�������̼���ƺ�̼�����ơ����ɶ�����̼��������50mL���ᣬ����NaHCO3+HCl=NaCl+H2O+CO2������֪CO2�������״���£�Ϊ0.05L �� 0.1 mol/L �� 22.4 L/mol = 0.112L = 112mL��
��3������CO2�������ʱ����ʱ��Һ������ΪNaCl�����������ӡ��������غ��֪n��NaOH��=n��NaCl��=n��HCl��=0.075L��0.1mol/L=0.0075mol����ԭ����������Һ��Ũ��=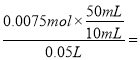 0.75mol/L��
0.75mol/L��

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�