题目内容
将10.6g Na2CO3溶于水配成250mL溶液,请计算:
(1)溶液中溶质的物质的量
(2)溶液中Na+和CO32— 的物质的量浓度
(1)溶液中溶质的物质的量
(2)溶液中Na+和CO32— 的物质的量浓度
(1)碳酸钠的摩尔质量是106g/mol,所以10.6g碳酸钠的物质的量是
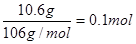 。
。
(2)碳酸钠的物质的量浓度是 。碳酸钠在水中完全电离,电离方程式为Na2CO3=2Na++CO32-,所以溶液中钠离子浓度为0.8mol/L,CO32— 的物质的量浓度0.4mol/L。
。碳酸钠在水中完全电离,电离方程式为Na2CO3=2Na++CO32-,所以溶液中钠离子浓度为0.8mol/L,CO32— 的物质的量浓度0.4mol/L。
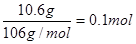 。
。(2)碳酸钠的物质的量浓度是
 。碳酸钠在水中完全电离,电离方程式为Na2CO3=2Na++CO32-,所以溶液中钠离子浓度为0.8mol/L,CO32— 的物质的量浓度0.4mol/L。
。碳酸钠在水中完全电离,电离方程式为Na2CO3=2Na++CO32-,所以溶液中钠离子浓度为0.8mol/L,CO32— 的物质的量浓度0.4mol/L。考查物质的量的有关计算。在进行这种类型的计算时,需要牢记以n为中心的有关的关系式。

练习册系列答案
相关题目