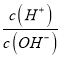题目内容
【题目】某化学学习小组为了探究镁和二氧化硫的反应产物,进行如下实验。
Ⅰ.设计如图所示装置完成镁和二氧化硫的反应。

(1)宓验室用亚疏酸钠与浓硫酸反应制备SO2,利用的是浓硫酸的___________
a.强氧化性 b.强酸性 c.脱水性 d.腐蚀性
(2)B装置中试剂的名称是_____________;E装置的作用是_________________。
Ⅱ.探究燃烧的反应产物
(3)反应后取C装置中的固体粉末于烧瓶F中,加入稀硫酸,有气体生成
①产生的气体中含有氢气,则可说明固体中含有______________
②将产生的气体通入硫酸铜溶液,出现黑色沉淀,这一现象的原因是______________ (用离子方程式表示)
(4)取出F装置烧瓶中的混合物,经过滤、干燥得到少量固体粉末,为了探究固体粉末的成分,选择下列装置进行实验:
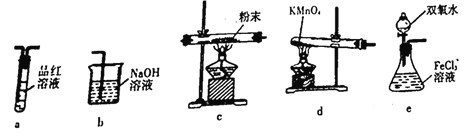
①按气体从左至右,选择所需装置,正确的连接顺序为______________(字母 )
②能证明固体粉末是硫磺的实验现象是_____________________。
(5)经测定,镁在二氧化硫中燃烧生成产物中有硫化镁、硫和氧化镁。如果m(MgO):m(MgS):m(S)=20:7:4,写出镁与SO2在加热条件下反应的化学方程式:________________。
【答案】 b 浓硫酸 吸收尾气中二氧化硫,防止空气中的水和二氧化碳与镁反应 Mg H2S+Cu2+=CuS↓+2H+ dcab 品红溶液褪色 5Mg+2SO2![]() 4MgO+S+MgS
4MgO+S+MgS
【解析】本题主要考查对于探究镁和二氧化硫的反应产物实验的评价。
Ⅰ.(1)宓验室用亚疏酸钠与浓硫酸反应制备SO2,发生复分解反应,利用的是浓硫酸的强酸性,故选b。
(2)B装置用来干燥二氧化硫气体,其中试剂的名称是浓硫酸;E装置的作用是吸收尾气中二氧化硫,防止空气中的水和二氧化碳与镁反应。
Ⅱ.(3)①产生的气体中含有氢气,则可说明固体中含有镁。
②将产生的气体通入硫酸铜溶液,出现黑色沉淀,这一现象的原因是H2S+Cu2+=CuS↓+2H+。
(4) ①按气体从左至右,装置连接顺序为制取氧气,氧气与硫反应,检验二氧化硫,吸收尾气,双氧水不能产生干燥氧气,所以选择d产生氧气,因此,正确的连接顺序为dcab。
②能证明固体粉末是硫磺的实验现象是品红溶液褪色。
(5)经测定,镁在二氧化硫中燃烧生成产物中有硫化镁、硫和氧化镁。如果m(MgO):m(MgS):m(S)=20:7:4,那么,n(MgO):n(MgS):n(S)=4:1:1,因此,镁与SO2在加热条件下反应的化学方程式:5Mg+2SO2 ![]() 4MgO+S+MgS。
4MgO+S+MgS。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是__________,B是____________(填化学式) 。
(2)写出C和D反应的离子方程式________________。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=____________________(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是________________。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是______。