题目内容
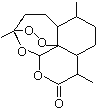
【题目】对如图装置(铁的防护)的分析正确的是( )
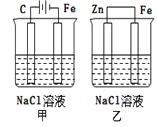
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
【答案】B
【解析】
甲装置是以碳为阳极,铁为阴极的电解池,实质为电解食盐水,阳极产生氯气,阴极产生氢气;乙装置是以锌为负极,铁为正极的原电池,发生锌的吸氧腐蚀。
A. 甲装置铁为阴极,不参与反应,属于外加电源的阴极保护法,A错误;
B. 乙装置铁为正极,正极氧气得电子,铁不参与反应,是牺牲阳极的阴极保护法,B正确;
C. 甲装置中电解氯化钠溶液生成氢氧化钠,溶液pH增大;乙装置中负极锌失去电子,最终产生氢氧化锌沉淀,溶液中的pH几乎不变,C错误;
D. 甲装置中铁电极水得电子产生氢气,乙装置铁电极氧气得电子产生氢氧根离子,D错误。
答案为B。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)单质化学性质最不活泼的是___;
(2)地壳中含量最多的元素是___(填名称);
(3)单质常用作半导体材料的是___;
(4)Mg原子结构示意图为___;
(5)O和S中,原子半径较大的是___;
(6)CH4和NH3中,热稳定性较强的是___(填名称);
(7)新制氯水有漂白作用,是因为其中含有___(填“HCl”或“HClO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),两性氢氧化物是___;
(9)某烃分子中含有6个碳原子,结构简式为![]() ,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
【题目】为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验。完成下列填空:
甲用重量法确定CO2的质量,装置如下图:
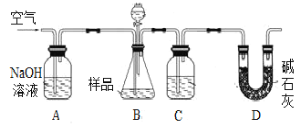
(1)B中反应的化学方程式为____________________________________________________。
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为___________________________________________________________。
(3)不能提高测定精确度的措施是___________。
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
乙用滴定法确定CO2的物质的量,将样品配制成100mL溶液,从中取出20.00 mL,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当______________________________________________________时,停止滴定。平行测定三次,有关实验数据记录如下表。m1 g样品产生CO2的物质的量为_____________。
实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
初读数 | 末读数 | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
丙用气体体积法确定CO2的体积,装置如图所示。

(4)为了减小实验误差,量气管中加入的液体X为___________________溶液;
(5)若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是____________________________________________________________________________。
(6)确定CO2的相对分子质量,选用___________________(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳。
【题目】某课外活动小组拟探究H+浓度对MnO2与H2O2反应速率的影响。现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
水的体积/mL | 15 | 14.5 | V4 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)实验Ⅰ发生反应的化学方程式为__,实验Ⅱ中MnO2的作用是__。
(2)上表中V1=__mL,V3=___mL。
(3)若实验测得t2>t3>t4,则可得出的实验结论是___。