题目内容
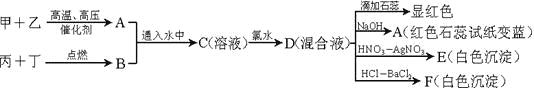
【题目】甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:
(1)用方程式解释A使湿润的红色石蕊试纸变蓝的原因___________________
(2)写出溶液C中加氯水的离子方程式___________________
(3)若A和B按1:1通入水中反应,写出反应方程式_________________。
【答案】NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- SO32-+Cl2+H2O =SO42-+2Cl-+2H+ SO2+NH3+H2O=NH4HSO3
NH4++OH- SO32-+Cl2+H2O =SO42-+2Cl-+2H+ SO2+NH3+H2O=NH4HSO3
【解析】
D的混合液中滴加石蕊试液,溶液显红色,说明溶液显酸性;加入NaOH溶液有使湿润红色石蕊试纸变蓝的气体,说明D溶液中含有NH4+;加入稀硝酸酸化后,再滴加AgNO3溶液,有白色沉淀生成,说明溶液中含有Cl-;加入盐酸酸化,再滴加BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;C溶液中通入氯水得到D溶液,再结合甲和乙生成A的反应条件,丙和丁点燃条件下生成B,并结合甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体;A和B以物质的量2︰1通入水中,得到C溶液。可知甲为H2、乙为N2、丙为O2,丁为S,A为NH3、B为SO2,C溶液为(NH4)2SO3溶液,C中通入氯水后所得的D溶液中含有SO42-、Cl-、NH4+,据此分析解题。
(1)由分析知A为NH3,因其电离使水溶液显碱性,使湿润的红色石蕊试纸变蓝,发生反应的方程式和电离方程式为NH3 + H2O ![]() NH3·H2O
NH3·H2O![]() NH4++OH-;
NH4++OH-;
(2) C溶液为(NH4)2SO3溶液,C中通入氯水后所得的D溶液中含有SO42-、Cl-、NH4+,发生反应的离子方程式为SO32-+Cl2+H2O =SO42-+2Cl-+2H+;
(3) NH3和SO2按1:1通入水中生成NH4HSO3,发生反应的方程式为SO2+NH3+H2O=NH4HSO3。

 阅读快车系列答案
阅读快车系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.混合气体中氢气的质量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应:N2(g)+3H2(g)![]() 2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
(2)肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为_____________________。



