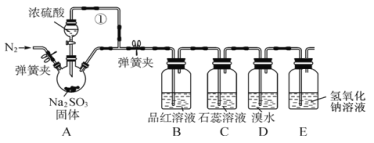
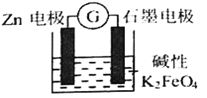
题目内容
【题目】某温度时,在一个2L的密闭容器中, X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应至第2分钟X、Y、Z的物质的量不再变化,Y所占的体积分数为_____。
(2)该反应的化学方程式为_______________________________________________
(3)反应开始至2min,气体Z的平均反应速率为____________ 。
【答案】50.0% 3X+Y![]() 2Z 0.05 molL-1min-1
2Z 0.05 molL-1min-1
【解析】
(1) 从图象可知,2min时到达平衡状态,X、Y、Z的物质的量分别为0.7mol、0.9mol、0.2mol,依据体积分数等于物质的量分数计算;
(2)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图象数据计算X、Y、Z的计量数之比,写出化学方程式;
(3)根据![]() =
=![]() 计算前2min内Z的平均反应速率。
计算前2min内Z的平均反应速率。
(1) 从图象可知,2min时到达平衡状态,X、Y、Z的物质的量分别为0.7mol、0.9mol、0.2mol,则Y所占的体积分数为 ![]() ×100%=50.0%;
×100%=50.0%;
因此,本题正确答案是:50.0%;
(2)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,由图象知,该反应中参加反应的![]() n(X)=(1.0-0.7)mol=0.3mol、
n(X)=(1.0-0.7)mol=0.3mol、![]() n(Y)=(1.0-0.9)mol=0.1mol、
n(Y)=(1.0-0.9)mol=0.1mol、![]() n(Z)=(0.2-0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,则该反应方程式为3X+Y2Z,
n(Z)=(0.2-0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,则该反应方程式为3X+Y2Z,
因此,本题正确答案是:3X+Y2Z;
(3)![]() (Z)=
(Z)=![]() =
=![]() = 0.05molL-1min-1,
= 0.05molL-1min-1,
因此,本题正确答案是:0.05molL-1min-1。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案