题目内容
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1氢氧化钠溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60 mLB. 45 mLC. 30 mLD. 15 mL
【答案】A
【解析】
足量Cu与一定浓硝酸反应生成硝酸铜与NO2、N2O4、NO的混合气体,硝酸没有剩余,混合气体与氧气混合通入水中又生成硝酸,纵观整个过程,Cu失去的电子数等于氧气获得的电子数,根据电子守恒计算铜的物质的量;
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,计算n(NaOH);
根据NaOH溶液的浓度计算消耗氢氧化钠溶液体积即可。
NO2、N2O4、NO的混合气体,这些气体与1.68 LO2(标准状况)混合后通入水中,完全生成HNO3,则整个过程中HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒:
n(Cu)×2=n(O2)×4,得n(Cu)×2=![]() ×4,解得:n(Cu)=0.15mol,所以Cu(NO3)2为0.15mol,根据
×4,解得:n(Cu)=0.15mol,所以Cu(NO3)2为0.15mol,根据
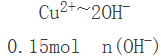
则NaOH为0.15mol×2=0.3mol;
则NaOH体积V=![]() =
= ![]() ,即60mL,A项正确;
,即60mL,A项正确;
答案选A。

 阅读快车系列答案
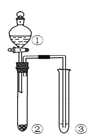
阅读快车系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D