题目内容
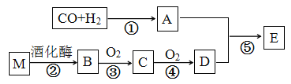
【题目】已知:烃的衍生物A的摩尔质量为32 g·molˉ1,且能与金属钠反应。E的分子式为C3H6O2。有关物质的转化关系如下:
请回答:
(1)D中含有的官能团名称是____________,反应⑤的反应类型为_________。
(2)写出烃的衍生物A与金属钠反应的化学方程式__________________________。
(3)写出反应②的化学方程式____________。写出反应③的化学方程式______________。
(4)写出有机物E与NaOH溶液反应的化学方程式_______________________。
(5)下列说法正确的是________。
A.有机物C的水溶液常用于标本的防腐
B.有机物B、D都能与金属钠发生反应
C.有机物E中混有D,可用饱和碳酸钠溶液进行分离
D.有机物M为高分子化合物
【答案】羧基 酯化(或取代) 2CH3OH+2Na→2CH3ONa+H2↑ C6H12O6 ![]() 2C2H5OH+2CO2 2CH3CH2OH+O2
2C2H5OH+2CO2 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOCH3+ NaOH→ CH3COONa+CH3OH BC
2CH3CHO+2H2O CH3COOCH3+ NaOH→ CH3COONa+CH3OH BC
【解析】
烃的衍生物A的摩尔质量为32g·molˉ1,且能与金属钠反应说明含有醇羟基,可知A为CH3OH,E的分子式为C3H6O2,应为CH3COOCH3,则可知D为CH3COOH,则C为CH3CHO,B为CH3CH2OH,M为葡萄糖,以此解答该题。
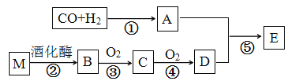
(1)D为CH3COOH,含有的官能团名称是羧基;反应⑤为甲醇和乙酸发生酯化反应生成乙酸甲酯,反应类型为取代反应(或酯化反应);
(2)烃的衍生物A为CH3OH,其与金属钠反应生成氢气的化学方程式为2CH3OH+2Na→2CH3ONa+H2↑;
(3)反应②为葡萄糖在酒化酶的催化作用下生成乙醇和CO2,发生反应的化学方程式为C6H12O6 ![]() 2C2H5OH+2CO2;反应③为乙醇的催化氧化生成乙醛,发生反应的化学方程式为2CH3CH2OH+O2
2C2H5OH+2CO2;反应③为乙醇的催化氧化生成乙醛,发生反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(4)有机物E为乙酸甲酯在NaOH溶液中发生水解的反应的化学方程式为CH3COOCH3+ NaOH→ CH3COONa+CH3OH;
(5)A.有机物C为乙醛,而甲醛的水溶液常用于标本的防腐,故A错误;B.羟基和羧基均能与Na反应,有机物B为乙醇含有羟基、D为乙酸含有羧基,则两者都能与金属钠发生反应生成氢气,故B正确;C.乙酸可与碳酸钠溶液反应而除去,乙酸甲酯不溶于水,则有机物E中混有D,可用饱和碳酸钠溶液进行分离,故C正确;D.有机物M为葡萄糖,不是高分子化合物,故D错误;故答案为BC。

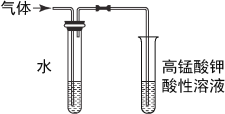
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
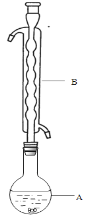
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。