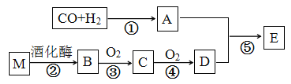
题目内容
【题目】实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为__________。它有______种同分异构体。若该烃与![]() 发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
(2)若该有机物分子中只有一个氧原子,其分子式为_____________________。
(3)若该有机物![]() 完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
【答案】C5H12 3 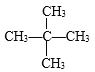 C4H8O C3H4O2
C4H8O C3H4O2
【解析】
(1)用商余法计算确定物质的分子式,然后根据烃的类别判断其同分异构体数目,若该烃与Cl2发生取代反应,生成的一氯代物只有1种,说明该烃分子中只有一种位置的H原子;
(2)O原子相对原子质量是16,用相对分子质量与O原子相对原子质量的差除12,得到的商为C原子数,余数为H原子数,从而可得物质的分子式;
(3)3.6g有机物中O元素质量为3.6g-0.15mol×12g/mol-0.1mol×2×1g/mol=1.6g,则氧原子物质的量为n(O)=![]() =0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。
=0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。
(1)相对分子质量为72的某烃,其中含有的C原子数可能:72÷12=5……12,因此可确定该物质分子为C5H12;其可能的同分异构体有CH3CH2CH2CH2CH3、![]() 、
、 三种结构;若该烃与Cl2发生取代反应,生成的一氯代物只有1种,说明该烃分子中只有一种位置的H原子,该物质结构为
三种结构;若该烃与Cl2发生取代反应,生成的一氯代物只有1种,说明该烃分子中只有一种位置的H原子,该物质结构为 ;
;
(2)若该有机物分子中只含有1个O原子,则其中含有的C、H两种元素的相对原子质量的和为72-16=56,含有的56÷12=4……8,说明分子中含4个C原子,8个H原子,因此该物质分子式为C4H8O;
(3)3.6g有机物中O元素质量为3.6g-0.15mol×12g/mol-0.1mol×2×1g/mol=1.6g,则氧原子物质的量为n(O)=![]() =0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。
=0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。

 名校课堂系列答案
名校课堂系列答案