题目内容
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如图所示:
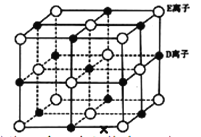
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
【答案】C O N sp3 哑铃型 3d104s1 3:4 Na、Cs处于同一主族,并都是金属晶体,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低 8 ![]()
【解析】
A、B、C、D、E、F为前四周期元素且原子序数依次增大,基态A原子的电子分布在3个能级,且每个能级所含的电子数相同,A原子核外有6个电子,A是C元素;D是短周期元素中电负性最小的元素,D是Na元素;C的原子核外最外层有 6 个运动状态不同的电子,则C最外层电子数为6,C是O元素、B是N元素;E的最高价氧化物的水化物酸性最强,E是Cl元素;基态F原子核外最外层只有一个电子,其余能层均充满电子,F是Cu元素。G元素与D元素同主族,且相差3个周期,G是Cs元素。
根据以上分析,(1)元素 A、 B、 C 分别是C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道处于半充满状态,N的第一电离能大于O,所以第一电离能由小到大的是C<O<N。(2)E是Cl元素,最高价含氧酸是HClO4, Cl价电子对数是![]() ,Cl的杂化方式为sp3。 基态 Cl原子中,最高能级是3p,电子云轮廓形状为哑铃型。(3)Cu原子核外有29个电子,3d能级处于全满或半满时为稳定结构,所以Cu外围电子排布式为3d104s1;(4)已知元素 C、N形成的(CN)2分子中所有原子都满足 8电子稳定结构,则(CN)2的结构式是N
,Cl的杂化方式为sp3。 基态 Cl原子中,最高能级是3p,电子云轮廓形状为哑铃型。(3)Cu原子核外有29个电子,3d能级处于全满或半满时为稳定结构,所以Cu外围电子排布式为3d104s1;(4)已知元素 C、N形成的(CN)2分子中所有原子都满足 8电子稳定结构,则(CN)2的结构式是N![]() C-C
C-C![]() N,则其分子中有3个σ键和4个π键,数目之比为3:4。(5)通常情况下,D单质是金属钠,G的单质是金属铯,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低,所以钠的熔沸点比铯高。(6)该晶胞棱上有12个碳原子,晶胞中心1个碳原子,“小立方体”中心各放置一个碳原子,所以晶胞中碳原子数是
N,则其分子中有3个σ键和4个π键,数目之比为3:4。(5)通常情况下,D单质是金属钠,G的单质是金属铯,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低,所以钠的熔沸点比铯高。(6)该晶胞棱上有12个碳原子,晶胞中心1个碳原子,“小立方体”中心各放置一个碳原子,所以晶胞中碳原子数是![]() ;晶胞的摩尔质量是8
;晶胞的摩尔质量是8![]() 12g/mol=96g/mol,把晶胞分成4个小立方体,每个立方体的对角线是键长的2倍,可推出整个晶胞的边长是
12g/mol=96g/mol,把晶胞分成4个小立方体,每个立方体的对角线是键长的2倍,可推出整个晶胞的边长是![]() ,晶胞的体积是
,晶胞的体积是![]() ,该晶体的密度是
,该晶体的密度是![]() g·cm-3。
g·cm-3。