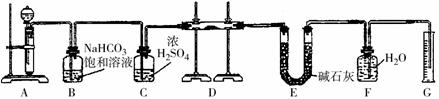
题目内容
Ca3(PO4)2、CaHPO4均为难溶于水的白色固体。某同学向Na2HPO4溶液中滴加CaCl2溶液至恰好反应,生成了白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是Ca3(PO4)2还是CaHPO4。
实验原理:______________________________
实验用品及试剂:试管、胶头滴管、______________________ _________
实验步骤、现象、结论(可不填满)
①_________________________________;②_______________________________;
③_________________________________;④_______________________________。
实验原理:______________________________
实验用品及试剂:试管、胶头滴管、______________________ _________
实验步骤、现象、结论(可不填满)
①_________________________________;②_______________________________;
③_________________________________;④_______________________________。
:若生成的混合物显强酸性,则白色沉淀为Ca3(PO4)2:2Na2HPO4+3CaCl2=Ca3(PO4)2↓+4NaCl+2HCl,若生成的混合物不显酸性,则白色沉淀为CaHPO4: Na2HPO4+CaCl2=CaHPO4↓+2NaCl;璃棒、pH试纸;①取一支洁净试管,向其中加入少量Na2HPO4溶液,然后滴加过量的CaCl2溶液;②静置;③用玻璃棒蘸取上层清液滴到pH试纸上,若溶液呈现酸性(CaCl2溶液显中性),则证明生成的沉淀为Ca3(PO4)2;反之则为CaHPO4。
:解答此类题要做到三点:①分析题给条件,通过物质的结构、性质、物质间的反应确定实验的原理;②方案的设计应优中选优,装置简单、药品用量少且经济,效果明显,操作安全步骤少;③语言文字力求简洁、准确、全面、到位。
实验原理:若生成的混合物显强酸性,则白色沉淀为Ca3(PO4)2:2Na2HPO4+3CaCl2=Ca3(PO4)2↓+4NaCl+2HCl,若生成的混合物不显酸性,则白色沉淀为CaHPO4: Na2HPO4+CaCl2=CaHPO4↓+2NaCl。
实验用品及试剂:玻璃棒、pH试纸
实验步骤、现象、结论:①取一支洁净试管,向其中加入少量Na2HPO4溶液,然后滴加过量的CaCl2溶液;②静置;③用玻璃棒蘸取上层清液滴到pH试纸上,若溶液呈现酸性(CaCl2溶液显中性),则证明生成的沉淀为Ca3(PO4)2;反之则为CaHPO4。
实验原理:若生成的混合物显强酸性,则白色沉淀为Ca3(PO4)2:2Na2HPO4+3CaCl2=Ca3(PO4)2↓+4NaCl+2HCl,若生成的混合物不显酸性,则白色沉淀为CaHPO4: Na2HPO4+CaCl2=CaHPO4↓+2NaCl。
实验用品及试剂:玻璃棒、pH试纸
实验步骤、现象、结论:①取一支洁净试管,向其中加入少量Na2HPO4溶液,然后滴加过量的CaCl2溶液;②静置;③用玻璃棒蘸取上层清液滴到pH试纸上,若溶液呈现酸性(CaCl2溶液显中性),则证明生成的沉淀为Ca3(PO4)2;反之则为CaHPO4。

练习册系列答案
相关题目
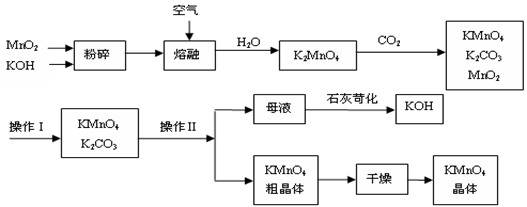
 CuSO4。②由Cu
CuSO4。②由Cu CuSO4,试回答:
CuSO4,试回答: