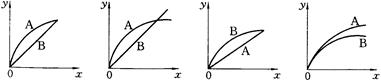题目内容
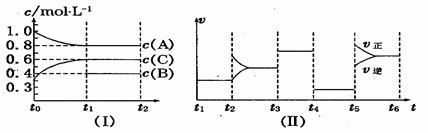
(12分)I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中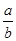 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:____________
(3)平衡时,N的转化率为 。
(4)下列叙述中能说明上述反应达到平衡状态的是
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
II、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。则燃烧1molH2放出的热量为 kJ。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中
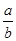 =__________
=__________ (2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:____________
(3)平衡时,N的转化率为 。
(4)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
F.N的质量分数在混合气体中保持不变
II、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。则燃烧1molH2放出的热量为 kJ。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
I、(1)2(2)1/(t2-t1)V mol·(L·min)-1 (3)75% (4)CEF
II:(1)286 (2)632
II:(1)286 (2)632
I、(1)根据图像可知反应进行到t1时N减少了8mol-6mol=2mol,M增加了3mol-2mol=1mol,根据变化量之比是相应的化学计量数之比可知a︰b=2︰1。
(2)t1到t2时刻M的物质的量增加了4mol-3mol=1mol,反应速率通常用单位时间内浓度的变化量来表示,因此以M的浓度变化表示的平均反应速率为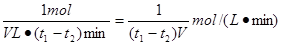 。
。
(3)平衡时N的物质的量减少了8mol-2mol=6mol,所以其转化率是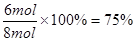 。
。
(4)M与N的物质的量之比为1︰1,不能得出正逆反应速率是否相等,A不能说明。根据质量守恒定律可知,质量始终是不变的,B不能说明。因为反应是体积减小的反应,所以在反应过程中气体的物质的量和压强是变化的,直到达到平衡才不再变化,C、E可以说明。选项D中的速率方向是相同的,因此不能说明。选项F属于化学平衡状态的特征,可以说明。
II、(1)1molH2是2g,所以放出的热量是143kJ·g-1×2g=286kJ。
(2)反应热等于断键所吸收的热量和成键所放出的热量的差值,即946kJ+498kJ-2×x=180kJ,解得x=632kJ。
(2)t1到t2时刻M的物质的量增加了4mol-3mol=1mol,反应速率通常用单位时间内浓度的变化量来表示,因此以M的浓度变化表示的平均反应速率为
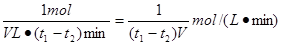 。
。(3)平衡时N的物质的量减少了8mol-2mol=6mol,所以其转化率是
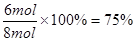 。
。(4)M与N的物质的量之比为1︰1,不能得出正逆反应速率是否相等,A不能说明。根据质量守恒定律可知,质量始终是不变的,B不能说明。因为反应是体积减小的反应,所以在反应过程中气体的物质的量和压强是变化的,直到达到平衡才不再变化,C、E可以说明。选项D中的速率方向是相同的,因此不能说明。选项F属于化学平衡状态的特征,可以说明。
II、(1)1molH2是2g,所以放出的热量是143kJ·g-1×2g=286kJ。
(2)反应热等于断键所吸收的热量和成键所放出的热量的差值,即946kJ+498kJ-2×x=180kJ,解得x=632kJ。

练习册系列答案
相关题目
 CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol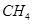 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
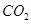 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中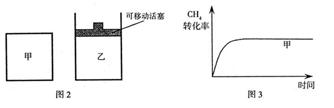
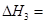 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
 (正)
(正) (逆) b.
(逆) b. 2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。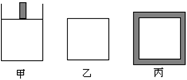
 N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题: 2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是( )
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是( ) pC(g)+qD(g)
pC(g)+qD(g)