��Ŀ����
(12��)�ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϡ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)+H2O(g) CO(g)+3H2(g) �SH1="+206.1" kJ/mol
CO(g)+3H2(g) �SH1="+206.1" kJ/mol
��CH4(g)+CO2(g) 2CO(g)+2H2(g) �SH2="+247.3" kJ/mol
2CO(g)+2H2(g) �SH2="+247.3" kJ/mol
��CO(g)+H2O(g) CO2(g)+ H2(g) �SH3
CO2(g)+ H2(g) �SH3
��ش��������⣺
(1)��һ�ܱ������н��з�Ӧ�٣����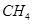 �����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ��10minʱ���ı��������������� ��
�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ��10minʱ���ı��������������� ��

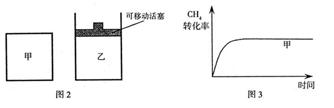
(2)��ͼ2��ʾ���ڼס����������зֱ��������ʵ�����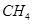 ��
��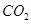 ��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������
��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������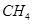 ��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������
��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������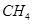 ��ת������ʱ��仯��ͼ��
��ת������ʱ��仯��ͼ��
(3)��Ӧ����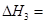 ��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���

��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ�� (�����)��
a��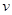 (��)
(��)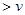 (��) b��
(��) b��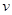 (��)<
(��)<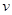 (��) c��
(��) c��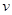 (��)=
(��)=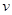 (��) d�����ж�
(��) d�����ж�
��4��800Kʱ������ʼ�����ͬ���ܱ������г���2mol SO2��1mol O2���䷴Ӧ��2SO2(g)+O2(g) 2SO3(g)����H=��96.56 kJ?mol-1���������ڷ�Ӧ�����б���ѹǿ���䣬����������������䣬������ά�־��ȣ����������Խ�����ѧƽ�⡣
2SO3(g)����H=��96.56 kJ?mol-1���������ڷ�Ӧ�����б���ѹǿ���䣬����������������䣬������ά�־��ȣ����������Խ�����ѧƽ�⡣
��1���ﵽƽ��ʱ��ƽ�ⳣ��K (��) K (��) K(��)���>������<����=������
��2���ﵽƽ��ʱSO2��Ũ��C(SO2)(��) C(SO2) (��) C(SO2) (��)���>������<����=������
��CH4(g)+H2O(g)
 CO(g)+3H2(g) �SH1="+206.1" kJ/mol
CO(g)+3H2(g) �SH1="+206.1" kJ/mol��CH4(g)+CO2(g)
 2CO(g)+2H2(g) �SH2="+247.3" kJ/mol
2CO(g)+2H2(g) �SH2="+247.3" kJ/mol ��CO(g)+H2O(g)
 CO2(g)+ H2(g) �SH3
CO2(g)+ H2(g) �SH3��ش��������⣺
(1)��һ�ܱ������н��з�Ӧ�٣����
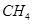 �����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ��10minʱ���ı��������������� ��
�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ��10minʱ���ı��������������� ��
(2)��ͼ2��ʾ���ڼס����������зֱ��������ʵ�����
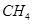 ��
��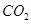 ��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������
��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������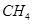 ��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������
��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������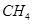 ��ת������ʱ��仯��ͼ��
��ת������ʱ��仯��ͼ��
(3)��Ӧ����
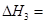 ��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ�� (�����)��
a��
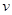 (��)
(��)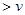 (��) b��
(��) b��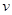 (��)<
(��)<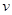 (��) c��
(��) c��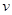 (��)=
(��)=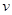 (��) d�����ж�
(��) d�����ж���4��800Kʱ������ʼ�����ͬ���ܱ������г���2mol SO2��1mol O2���䷴Ӧ��2SO2(g)+O2(g)
 2SO3(g)����H=��96.56 kJ?mol-1���������ڷ�Ӧ�����б���ѹǿ���䣬����������������䣬������ά�־��ȣ����������Խ�����ѧƽ�⡣
2SO3(g)����H=��96.56 kJ?mol-1���������ڷ�Ӧ�����б���ѹǿ���䣬����������������䣬������ά�־��ȣ����������Խ�����ѧƽ�⡣
��1���ﵽƽ��ʱ��ƽ�ⳣ��K (��) K (��) K(��)���>������<����=������
��2���ﵽƽ��ʱSO2��Ũ��C(SO2)(��) C(SO2) (��) C(SO2) (��)���>������<����=������
(1) �����¶�
(2)
(3) ��41.2 KJ/mol a ��4�� ��1�� = > ��2��< <
(2)

(3) ��41.2 KJ/mol a ��4�� ��1�� = > ��2��< <
��1������ͼ1���ã�10minʱ��C��CH4����С����Ҫ����е�ƽ�������ƶ��������£���ʹ��ƽ�������ƶ���
��2���ס�������ͬ�¶��·�����Ӧ�ڣ��Ҿ�������ʼ��Ӧ�����б��ֺ��ݣ����б��ֺ�ѹ��
���Ҷ��ԣ����ŷ�Ӧ��������У��ݻ�������P��<P������ѹǿԽС����Ӧ����ԽС����������<����������ʱ��t��>t������ѹǿ��С��ƽ��ڽ������ƶ�����CH4��ת���ʣ���>�ף�
��3���� - ��= �ۣ���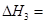 �SH2-�SH1=��206.1-247.3��=��41.2 kJ/mol��
�SH2-�SH1=��206.1-247.3��=��41.2 kJ/mol��
���ñ������ݣ���Ũ�Ȼ�Q=[C(CO2)��C(H2)]/[C(CO)��C(H2O)]=��2��2��/(0.5��8.5)=0.94��
��K=1.0����Q<K��ƽ��Ҫ�����ƶ�����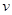 (��)
(��)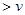 (��)��
(��)��
��4����1���ס������¶���ȣ���K (��)="K" (��)��
��H=��96.56 kJ?mol-1 <0��˵�������Ƿ��ȷ�Ӧ�������־��ȣ���Ӧ�ų���������ʹ��ϵ�¶����ߣ�������ʱ����ƽ�������ƶ�����Kֵ��С����K (��)="K" (��) > K(��)��
��2���ס����бȽϣ���ʼ������ͬ���ױ���ѹǿ���䣬����������������䣬�����У����ŷ�Ӧ��������У�����������٣���P��<P������ѹǿ��Сʱ��ƽ�⽫�����ƶ�����C(SO2)(��)<C(SO2) (��)��
�ҡ����бȽϣ���ʼ������ͬ������������������䣬������ά�־��ȣ�����У���Ӧ�ų���������ʹ��ϵ�¶����ߣ�������ʱ����ƽ�������ƶ�����C(SO2) (��) <C(SO2) (��)��
��2���ס�������ͬ�¶��·�����Ӧ�ڣ��Ҿ�������ʼ��Ӧ�����б��ֺ��ݣ����б��ֺ�ѹ��
���Ҷ��ԣ����ŷ�Ӧ��������У��ݻ�������P��<P������ѹǿԽС����Ӧ����ԽС����������<����������ʱ��t��>t������ѹǿ��С��ƽ��ڽ������ƶ�����CH4��ת���ʣ���>�ף�
��3���� - ��= �ۣ���
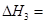 �SH2-�SH1=��206.1-247.3��=��41.2 kJ/mol��
�SH2-�SH1=��206.1-247.3��=��41.2 kJ/mol�����ñ������ݣ���Ũ�Ȼ�Q=[C(CO2)��C(H2)]/[C(CO)��C(H2O)]=��2��2��/(0.5��8.5)=0.94��
��K=1.0����Q<K��ƽ��Ҫ�����ƶ�����
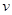 (��)
(��) (��)��
(��)����4����1���ס������¶���ȣ���K (��)="K" (��)��
��H=��96.56 kJ?mol-1 <0��˵�������Ƿ��ȷ�Ӧ�������־��ȣ���Ӧ�ų���������ʹ��ϵ�¶����ߣ�������ʱ����ƽ�������ƶ�����Kֵ��С����K (��)="K" (��) > K(��)��
��2���ס����бȽϣ���ʼ������ͬ���ױ���ѹǿ���䣬����������������䣬�����У����ŷ�Ӧ��������У�����������٣���P��<P������ѹǿ��Сʱ��ƽ�⽫�����ƶ�����C(SO2)(��)<C(SO2) (��)��
�ҡ����бȽϣ���ʼ������ͬ������������������䣬������ά�־��ȣ�����У���Ӧ�ų���������ʹ��ϵ�¶����ߣ�������ʱ����ƽ�������ƶ�����C(SO2) (��) <C(SO2) (��)��

��ϰ��ϵ�д�
�����Ŀ
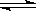 2HF
2HF 
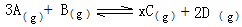
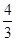 mol��Ҫʹƽ��ʱ�����ʵİٷֺ���������ƽ����ͬ����Ҫ����______mol______ ����.
mol��Ҫʹƽ��ʱ�����ʵİٷֺ���������ƽ����ͬ����Ҫ����______mol______ ����. 2C(g)���ﵽƽ��ı�־��
2C(g)���ﵽƽ��ı�־��  PCl3��g��+Cl2��g������H1>0 K1=1mol��L��1
PCl3��g��+Cl2��g������H1>0 K1=1mol��L��1 bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
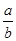 =__________
=__________  2C(��)+2D(��)�ﵽƽ��ı�־���� ( )
2C(��)+2D(��)�ﵽƽ��ı�־���� ( )