题目内容
水的电离平衡曲线如图所示, 若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是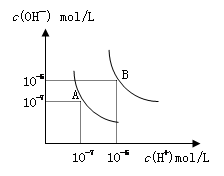
| A.纯水中25℃时的c(H+)比100℃时的c(H+)大 |
| B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3 |
| C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1 |
| D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1 |
D
解析试题分析:A选项错误。25℃时c(H+)=c(OH-)为10-6mol/L,当100℃时c(H+)=c(OH-)为10-7mol/L。B选项错误。100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,又因为当100摄氏度时KW值为1.0×10-12,故PH可能是11或1。C选项错误。若将pH=9的Ba(OH)2溶液与pH=4的稀盐酸按照体积比10: 1混合,得到位中性溶液。在100摄氏度时中性溶液PH=6,故错误。D选项争取。
考点:水的离子积

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液一定呈中性的是
| A.pH=7的溶液 | B.c(H+)=c(OH-)的溶液 |
| C.非电解质溶于水得到的溶液 | D.由强酸、强碱等物质的量反应得到的溶液 |
已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O 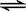 CH3COO—+H3O+ K1=1.75×10-5
CH3COO—+H3O+ K1=1.75×10-5
CH3COO—+H2O 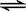 CH3COOH+OH— K2=5.71×10-10
CH3COOH+OH— K2=5.71×10-10
现有50 mL 0.2 mol·L-1醋酸与50 mL 0.2 mol·L-1醋酸钠混合制得溶液甲,下列叙述正确的是
| A.甲溶液的pH >7 |
| B.对甲进行微热,K1、K2同时增大 |
| C.若在甲中加入很少量的NaOH溶液,溶液的pH几乎不变 |
| D.若在甲中加入5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的K1会变大 |
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,其简单离子都能促进水的电离的是
| A.W2-、X+ | B.X+、Y3+ | C.X+、Z2- | D.Y3+、Z2- |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH¯)>c(N3¯)>c(H+) |
| D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
下列物质加入水中,对水的电离能产生促进作用的是
| A.NH4Cl | B.NaOH | C.NaCl | D.H2SO4 |
某温度下,
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液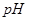 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D.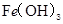 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |