题目内容
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
BD
解析试题分析:A、HCO3—水解生成H2CO3和OH—,HCO3—电离生成CO32—和H+,由于pH=10,说明水解程度大于电离,错误;B、水解、电离都是微弱的,正确;C、根据电荷守恒式,应为c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH―),错误;D、由物料守恒式,n(Na):n(C)=1:1,正确。
考点:考查电解质溶液中的守恒式及离子浓度大小比较。

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
下列粒子能促进水的电离,且使溶液呈酸性是
| A.CO32- | B.Fe3+ | C.HSO4- | D.Cl- |
可以判定某酸HA是弱电解质的事实是
| A.HA能与水以任意比互溶 |
| B.0.1 mol·L-1HA溶液的pH约为3 |
| C.HA可与NaHCO3反应放出CO2 |
| D.HA溶液的导电能力很差 |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH?) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH?) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
水的电离平衡曲线如图所示, 若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是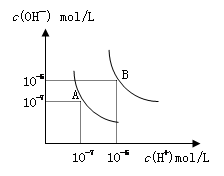
| A.纯水中25℃时的c(H+)比100℃时的c(H+)大 |
| B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3 |
| C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1 |
| D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1 |
有①Na2CO3溶液;②CH3C00Na溶液;③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,
下列说法正确的是( )
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1 mol/L盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
下列有关叙述正确的是 ( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
等物质的量浓度的下列溶液中,c( )最大的是( )
)最大的是( )
| A.NH4HCO3 | B.NH4NO3 | C.(NH4)2CO3 | D.NH4HSO4 |
现有浓度均为0.10mol·L-1的醋酸V1 mL和氢氧化钠溶液V2 mL,下列说法正确的是
| A.常温下,上述溶液中,醋酸溶液的pH=1,氢氧化钠溶液的pH=13 |
| B.常温下,若两溶液混合后pH=7,则混合液:c(Na+)=c(CH3COO-) |
| C.若 V1= V2,将两溶液混合,所得混合液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.V1与V2任意比混合,所得混合液:c (Na+)+ c(H+) =c(OH-)+ c (CH3COO-) |