题目内容
【题目】下表为元素周期表的一部分。请回答下列问题:

(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式___________________________。
(3)元素第一电离能为⑤____________⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有___________对弧对电子,其VSEPR模型为_________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________ ___________。
【答案】(1)H、Mg、Ca;(2)[Ar]3d54s1(3)大于;(4)1;四面体;sp3;极性;先产生白色沉淀,后溶解沉淀溶解
【解析】试题分析:(1)由图可知①⑤⑨处于s区,由①位于第一周期第ⅠA族,是氢元素;⑤位于第三周期第ⅡA族,是镁元素;⑨位于第四周期第ⅡA族,是钙元素;故答案为:H、Mg、Ca;(2)元素⑩是Cr元素,其基态原子价电子为3d、4s能级上电子,3d、4s能级上分别含有5、1个电子,所以其价电子排布式为[Ar]3d54s1;(3)元素⑤与⑨处于同一主族,元素⑨核电荷数大,金属性更强,第一电离能小.故答案为:大于;(4)元素③为N元素,其气态氢化物为NH3,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;N原子的杂化轨道数为4,所以N原子采取sp3杂化;NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子;往AgNO3溶液中逐滴加入氨水,银离子和氨水反应生成白色的氢氧化银沉淀和铵根离子,离子反应方程式为:Ag++NH3H2O═AgOH↓+NH4+;继续滴入氨水白色沉淀溶解,氢氧化银和氨水反应生成银氨溶液和水,离子反应方程式为:AgOH+2NH3H2O═[Ag(NH3)2]OH+2H2O,边滴边振荡直滴到沉淀溶解,故答案为:1;四面体;sp3;极性;先产生白色沉淀,后溶解沉淀溶解。

【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
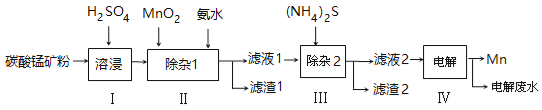
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)