题目内容
【题目】近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g) H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:___________________________________________。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
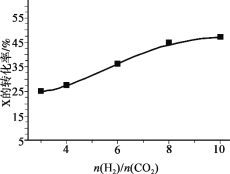
反应物X是_______(填“CO2”或“H2”)。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
①化学平衡常数K = _______。
②催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
【答案】3H2 (g)+CO2 (g) ![]() CH3OH(g)+H2O(g) ΔH=-48.9 kJ/mol d CO2 5.33 B
CH3OH(g)+H2O(g) ΔH=-48.9 kJ/mol d CO2 5.33 B
【解析】
(1)根据已知热化学方程式,利用盖斯定律进行分析,将①+②可得CO2催化氢化合成甲醇的热化学方程式,并据此计算焓变;
(2)有利于提高CH3OH平衡转化率,需要使平衡向着正向移动,结合平衡移动原理分析;
(3)根据同一反应,增加其中一种反应物的浓度,能提高另一种反应物的转化率,结合图示横坐标表示[n(H2)/n(CO2)],进行分析解答;
(4)①利用三段式计算平衡时各组分的物质的量浓度,再根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,计算平衡常数;
②分别对比AB、CD实验,Cu/ZnO纳米片催化剂使反应速率增加,甲醇选择性高,对比BD实验,温度升高,CO2转化率升高,而甲醇的选择性却降低,据此分析。
(1)已知:①CO2(g)+H2(g) H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1;
②CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0 kJmol-1;
利用盖斯定律可知,将①+②可得:CO2(g)+3H2(g)CH3OH(g)+H2O(g)则△H=(+41.1kJ/mol)+(90kJ/mol)=48.9kJ/mol;
故答案为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=48.9kJ/mol;
(2)CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=48.9kJ/mol;该反应是反应前后气体体积减小的反应,加压平衡正向移动,正反应为放热反应,降温平衡正向移动,则为提高CH3OH平衡转化率,即平衡需正向移动,采用的条件为低温高压;
故答案为:d;
(3)同一反应,增加其中一种反应物的浓度,能提高另一种反应物的转化率,而本身转化率降低,图示随着横坐标增大[n(H2)/n(CO2)],相当于C(CO2)不变时,增大C(H2),平衡正向移动,使二氧化碳的转化率增大,而氢气的转化率降低,所以X为CO2;
故答案为:CO2;
(4)①根据已知信息,可列出三段式:
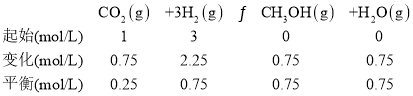
化学平衡常数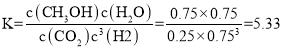 ;
;
故答案为:5.33;
②分别对比AB、CD实验,在同样温度下,Cu/ZnO纳米片催化剂使反应速率增加,甲醇选择性高,所以选择BD进行比较,同样催化剂条件下,温度升高,CO2转化率升高,而甲醇的选择性却降低,所以用CO2生产甲醇的最优选项为B;
故答案为:B。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中![]() 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计![]() ,使其达到分解平衡:
,使其达到分解平衡:![]() 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应![]() 、
、![]() ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算![]() 时的分解平衡常数约为
时的分解平衡常数约为![]()