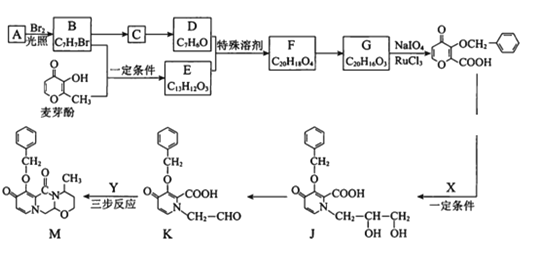
题目内容
【题目】回答问题:
Ⅰ.常温下,CaS的Ksp=10-8,饱和溶液中存在平衡: CaS(s)![]() Ca2+(aq)+S2-(aq)
Ca2+(aq)+S2-(aq)
(1)①该温度下,将10-4mol/L氯化钙溶液与2×10-4mol/L硫化钠溶液等体积混合,能否产生沉淀?答___;温度升高时,Ksp__(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)___,原因是___(用文字和离子方程式说明)。
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___。
Ⅱ.(已知Ksp[Fe(OH)3]=10-38)若0.01mol/L FeCl3溶液中,如果要生成Fe(OH)3沉淀,应调整溶液pH,使pH___,若要使其沉淀完全,pH应___。(提示:填数据时,要有>,<,=)
【答案】浓度商Qc= c(Ca2+)![]() c(S2-)=5×10-5 mol/L×1×10-4mol/L=5×10-9 mol/L<Ksp=10-8,无沉淀生成 增大 增大 滴加少量浓盐酸后,HCl电离出的氢离子与硫离子结合,发生反应:2H++S2-=H2S,使溶液平衡CaS(s)
c(S2-)=5×10-5 mol/L×1×10-4mol/L=5×10-9 mol/L<Ksp=10-8,无沉淀生成 增大 增大 滴加少量浓盐酸后,HCl电离出的氢离子与硫离子结合,发生反应:2H++S2-=H2S,使溶液平衡CaS(s)![]() Ca2+(aq)+S2-(aq)向正向移动,c(Ca2+)增大 CaS(s) + Cu2+(aq)= CuS(s)+ Ca2+(aq) >2 >3
Ca2+(aq)+S2-(aq)向正向移动,c(Ca2+)增大 CaS(s) + Cu2+(aq)= CuS(s)+ Ca2+(aq) >2 >3
【解析】
Ⅰ.(1)①计算溶液混合后溶液中离子的浓度商Qc与Ksp的大小关系判断是否有沉淀产生;一般情况下,Ksp随着温度的升高而增大;
②根据化学反应对该沉淀溶解平衡的影响效果分析作答。
(2)铜离子会与硫离子结合生成硫化铜黑色沉淀;
Ⅱ.要生成Fe(OH)3沉淀,根据溶液中铁离子浓度为0.01mol/L计算;沉淀完全时,根据溶液中铁离子浓度最多为10-5mol/L计算,根据Ksp推导。
(1)将10-4mol/L氯化钙溶液与2×10-4mol/L硫化钠溶液等体积混合后,c(Ca2+) =5![]() 10-5 mol/L,c(S2-)=1×10-4mol/L,则浓度商Qc= c(Ca2+)
10-5 mol/L,c(S2-)=1×10-4mol/L,则浓度商Qc= c(Ca2+)![]() c(S2-)=5×10-5 mol/L×1×10-4mol/L=5×10-9 mol/L<Ksp=10-8,故无沉淀生成;CaS(s)
c(S2-)=5×10-5 mol/L×1×10-4mol/L=5×10-9 mol/L<Ksp=10-8,故无沉淀生成;CaS(s)![]() Ca2+(aq)+S2-(aq)为吸热反应,则温度升高时,Ksp增大,故答案为:浓度商Qc= c(Ca2+)
Ca2+(aq)+S2-(aq)为吸热反应,则温度升高时,Ksp增大,故答案为:浓度商Qc= c(Ca2+)![]() c(S2-)=5×10-5 mol/L×1×10-4mol/L=5×10-9 mol/L<Ksp=10-8,无沉淀生成;增大;
c(S2-)=5×10-5 mol/L×1×10-4mol/L=5×10-9 mol/L<Ksp=10-8,无沉淀生成;增大;
②滴加少量浓盐酸后会与硫离子结合生成硫化氢,其离子方程式为:2H++S2-=H2S,因此会破坏溶解平衡CaS(s)![]() Ca2+(aq)+S2-(aq),使平衡向正向移动,使c(Ca2+)增大,故答案为:增大;滴加少量浓盐酸后,HCl电离出的氢离子与硫离子结合,发生反应:2H++S2-=H2S,使溶液平衡CaS(s)
Ca2+(aq)+S2-(aq),使平衡向正向移动,使c(Ca2+)增大,故答案为:增大;滴加少量浓盐酸后,HCl电离出的氢离子与硫离子结合,发生反应:2H++S2-=H2S,使溶液平衡CaS(s)![]() Ca2+(aq)+S2-(aq)向正向移动,c(Ca2+)增大。
Ca2+(aq)+S2-(aq)向正向移动,c(Ca2+)增大。
(2)CaS悬浊液存在CaS(s)![]() Ca2+(aq)+S2-(aq) 平衡,若向中加入CuSO4溶液,发生复分解反应,生成黑色固体CuS,反应的离子方程式:CaS(s) + Cu2+(aq)= CuS(s)+ Ca2+(aq);
Ca2+(aq)+S2-(aq) 平衡,若向中加入CuSO4溶液,发生复分解反应,生成黑色固体CuS,反应的离子方程式:CaS(s) + Cu2+(aq)= CuS(s)+ Ca2+(aq);
Ⅱ.0.01mol/L FeCl3溶液中开始沉淀时c(Fe3+)=0.01mol/L,则c(OH-)=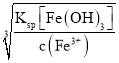 =
=![]() =1×10-12mol/L,根据Kw=1×10-14,因此c(H+)=
=1×10-12mol/L,根据Kw=1×10-14,因此c(H+)=![]() =1×10-2 mol/L,pH = -lgc(H+) = 2,也就是使Fe3+沉淀溶液所需的最小pH为2,即pH>2;若要使其沉淀完全,则溶液中Fe3+最大浓度为1×10-5,则c(OH-)=
=1×10-2 mol/L,pH = -lgc(H+) = 2,也就是使Fe3+沉淀溶液所需的最小pH为2,即pH>2;若要使其沉淀完全,则溶液中Fe3+最大浓度为1×10-5,则c(OH-)=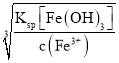 =
=![]() =1×10-11 mol/L,根据Kw=1×10-14,因此c(H+)=
=1×10-11 mol/L,根据Kw=1×10-14,因此c(H+)=![]() =1×10-3 mol/L,pH = -lgc(H+) = 3,pH应大于3,故答案为:>2;>3。
=1×10-3 mol/L,pH = -lgc(H+) = 3,pH应大于3,故答案为:>2;>3。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是一种重要的化工原料.
![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______span>
______span>
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
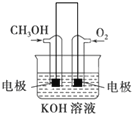
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .