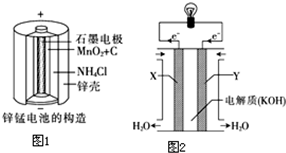
题目内容
3.(1)Cu(NO3)2的水溶液呈酸(填“酸”、“中”、“碱”)性,常温时的pH<7(填“>”、“=”、“<”),原因是(用离子方程式表示):Cu2++2H2O?Cu(OH)2+2H+;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制(填“促进”、“抑制”)其水解.
(2)氯化铝水溶液呈酸性,原因是(用离子方程式表示):Al3++3H2O?Al(OH)3+3H+.把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3.
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH.
分析 (1)Cu(NO3)2是强酸弱碱盐,铜离子水解导致溶液呈酸性;向溶液中加入酸抑制铜离子水解;
(2)氯化铝为强酸弱碱盐,铝离子水解而使其溶液呈酸性;AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,氢氧化铝可分解;
(3)硫化钠是强碱弱酸盐,硫离子水解导致溶液呈碱性,为防止水解应该在配制硫化钠溶液时加入少量碱.
解答 解:(1)Cu(NO3)2是强酸弱碱盐,铜离子水解导致溶液呈酸性,Cu2++2H2O?Cu(OH)2+2H+,常温下溶液的pH<7;向溶液中加入硝酸抑制铜离子水解,故答案为:酸;<;Cu2++2H2O?Cu(OH)2+2H+;抑制;
(2)AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,水解方程式为Al3++3H2O?Al(OH)3+3H+,盐酸易挥发,氢氧化铝可分解生成Al2O3,故答案为:酸;Al3++3H2O?Al(OH)3+3H+;Al2O3;
(3)硫化钠是强碱弱酸盐,硫离子水解导致溶液呈碱性,水解方程式为S2-+H2O?HS-+OH-,为防止水解应该在配制硫化钠溶液时加入少量NaOH,故答案为:NaOH.
点评 本题考查盐类水解,会根据盐的特点确定溶液酸碱性,会书写盐类水解方程式,知道抑制盐类水解的方法,题目难度不大注意知识的归纳和梳理是关键.

练习册系列答案
相关题目
13.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A | B | C | D | |
| 实 验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体 混合物中回收I2 | 配制100mL 0.1000 mol•L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
14.下列反应的离子方程式表示正确的是( )
| A. | 将过量的铁丝投入稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| C. | NH4HCO3溶液与过量的NaOH溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 小苏打溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
11.在糕点食品的制作过程中,常需要加入在一定条件下能放出气体而使糕点疏松的膨化剂.下列物质中,适宜作糕点膨化剂的是( )
| A. | CaCO3 | B. | NH4HCO3 | C. | Na2CO3 | D. | NH4Cl |
18.对于可逆反应2SO2 (g)+O2(g)?2SO3(g)△H<0在一定温度下其平衡数为K,下列说法正确的是( )
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | 升高温度K值增大 | D. | K值越大SO2转化率越大 |
8.1L 0.1mol•L-1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,设电解按理论进行,溶液不蒸发,下列判断正确的是( )
| A. | 转移的电子数是1.204×1022 | B. | 阳极上产生112 mL O2(标准状况) | ||
| C. | 溶液的浓度变化为0.08 mol•L-1 | D. | 反应中有0.01 mol Ag被氧化 |
12.把Ba(OH)2溶液滴入明矾溶液中,是SO42-全部转化为BaSO4沉淀,此时铝元素的主要存在形式是( )
| A. | 铝离子 | B. | 氢氧化铝 | ||
| C. | 四羟基合铝酸根离子 | D. | 铝离子和氢氧化铝 |
13.N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第四周期第VIIA族;Na和O形成1:1的化合物的电子式: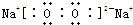 .该物质含有的化学键为:离子键和非极性键.
.该物质含有的化学键为:离子键和非极性键.
(2)用“>”或“<”填空:
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr$?_{放电}^{充电}$3Na2S2+Br2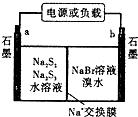
①放电时Na+向b极迁移(填“a或b,”).
②放电时负极的电极反应式为:3S22--2e-=2S32-
(4)已知N4为正四面体结构,N-N键能为167kJ•mol-1,N≡N键能为942kJ•mol-1.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
(1)Br位于元素周期表第四周期第VIIA族;Na和O形成1:1的化合物的电子式:
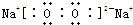 .该物质含有的化学键为:离子键和非极性键.
.该物质含有的化学键为:离子键和非极性键.(2)用“>”或“<”填空:
| 稳定性 | 粒子半径 | 熔点 | 键的极性 |
| NH3<H2O | O2-> Mg2+ | SO3< Na2O2 | H-O> H-N |

①放电时Na+向b极迁移(填“a或b,”).
②放电时负极的电极反应式为:3S22--2e-=2S32-
(4)已知N4为正四面体结构,N-N键能为167kJ•mol-1,N≡N键能为942kJ•mol-1.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.