题目内容
4.向50g FeCl3溶液中放入一小块Na,待反应完全后,过滤,得到仍有棕黄色的溶液45.9g,则投入的Na的质量为( )| A. | 4.6g | B. | 4.1g | C. | 6.9g | D. | 9.2g |
分析 向50g FeCl3溶液中放入一小块钠,发生:2Na+2H2O=2NaOH+H2↑,FeCl3+3NaOH=3NaCl+Fe(OH)3↓,过滤,得到仍有棕黄色的溶液,说明FeCl3过量,结合化学方程式从质量守恒的角度进行计算.
解答 解:设投入钠xmol,
2Na+2H2O=2NaOH+H2↑
2 2 1
xmol xmol 0.5xmol
FeCl3+3NaOH=3NaCl+Fe(OH)3↓
3 1
xmol $\frac{1}{3}$xmol
根据质量守恒,应有:50g+23xg=45.9g+2×0.5xg+$\frac{1}{3}$x×107g,
解得x=0.3,
则m(Na)=0.3mol×23g/mol=6.9g,
故选C.
点评 本题考查化学方程式的计算,题目难度不大,本题注意根据溶液的质量变化从质量守恒的角度解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 澄清石灰水跟稀硝酸反应:H++OH-═H2O | |
| C. | 氧化镁与醋酸反应:MgO+2H+═Mg2++H2O | |
| D. | 盐酸滴到铜片上:Cu+2H+═Cu2++H2↑ |
15.需要加入氧化剂才能发生的变化是( )
| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | Cl-→Cl2 | D. | Fe3+→Fe2+ |
12.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 碱性氧化物 氧化铁 FeO | B. | 酸性氧化物 碳酸气 C0 | ||
| C. | 酸 硫酸 H2S | D. | 盐 纯碱 Na2CO3 |
19.下列说法正确的是( )
| A. | 氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 | |
| B. | 硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 | |
| C. | 电解精炼铜时,粗铜作阳极,纯铜作阴极 | |
| D. | 工业合成氨通常采用400~500℃的高温主要是为了提高氮气的转化率 |
20.下列说法中正确的是( )
| A. | 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 | |
| B. | 青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金 | |
| C. | 漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂 | |
| D. | 合成纤维和光导纤维都是高分子化合物 |
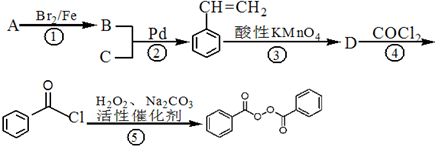
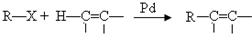
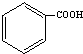 ;
;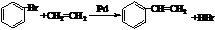 ;
; ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.