题目内容
14.下列离子方程式书写正确的是( )| A. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 澄清石灰水跟稀硝酸反应:H++OH-═H2O | |
| C. | 氧化镁与醋酸反应:MgO+2H+═Mg2++H2O | |
| D. | 盐酸滴到铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.碳酸氢根离子不能拆开,需要保留整体形式;
B.氢氧化钙与稀硝酸的反应实质为氢离子与氢氧根离子的反应;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.铜活泼性较差,不能与盐酸反应生成氢气.
解答 解:A.碳酸氢钠与稀硫酸反应生成氯化钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+H+═CO2↑+H2O,故A错误;
B.澄清石灰水跟稀硝酸反应生成硝酸钙和水,反应的离子方程式为:H++OH-═H2O,故B正确;
C.氧化镁与醋酸反应生成醋酸镁和水,反应的离子方程式为:MgO+2CH3COOH═Mg2++H2O+2CH3COO-,故C错误;
D.盐酸滴到铜片上,二者不发生反应,无法写出反应的离子方程式,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
4.解释下列现象的化学用语不正确的是( )
| A. | CH3COONa溶液中,滴加酚酞变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 向CU(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀黑色:Cu(OH)2(s)+S2-?CuS(s)+2OH- | |
| C. | 新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ |
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃下,若物质的浓度关系是c (CO2)•c (H2)>c (CO)•c (H2O),则此时正反应速率与逆反应速率的关系是a.
a.v正>v逆 b.v正=v逆 c.v正<v逆 d.无法判断
(5)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于 1.0 (填“大于”“等于”或“小于”)
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃下,若物质的浓度关系是c (CO2)•c (H2)>c (CO)•c (H2O),则此时正反应速率与逆反应速率的关系是a.
a.v正>v逆 b.v正=v逆 c.v正<v逆 d.无法判断
(5)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于 1.0 (填“大于”“等于”或“小于”)
2.某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )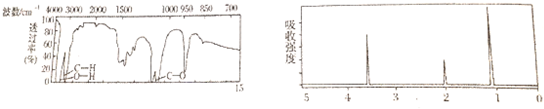

| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 无有机物A的分子式,仅由两个谱图信息,无法确定该物质的结构式 |
9.298K时,0.5molN2(g)与适量H2(g)转化成NH3(g)放出46.1kJ的热量,则表示该反应的热化学方程式正确的是( )
| A. | N2(g)+3H2(g)═2NH3(g)△H(298K)=+92.2kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H(298K)=-92.2kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H(298K)=+46.1kJ•mol-1 | |
| D. | N2(g)+3H2(g)═2NH3(g)△H(298K)=-46.1kJ•mol-1 |
19.NA代表阿伏加德罗常数,下列说法一定正确的是( )
| A. | NA个氢气分子所占的体积为22.4L | |
| B. | 40g烧碱溶于1L水中所得溶液中溶质的物质的量浓度等于1mol/L | |
| C. | 1L 0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 同温同压时,相同体积的任何气体所含的原子数一定相同 |
3.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Al(OH)3胶体 | C. | 盐酸 | D. | KOH溶液 |
4.向50g FeCl3溶液中放入一小块Na,待反应完全后,过滤,得到仍有棕黄色的溶液45.9g,则投入的Na的质量为( )
| A. | 4.6g | B. | 4.1g | C. | 6.9g | D. | 9.2g |