题目内容
5.已知电解食盐(NaCl)水是氯碱工业中的重要反应它与其他的物质的转化关系如图所示(部分产物以略去).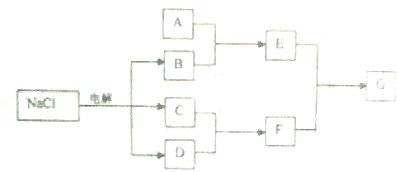
若A是第三周期一种金属元素的单质,能与B反应生成盐E,E与酸溶液F反应时,若酸溶液F过量时,G为可溶性盐,若当酸溶液F不足时,G为沉淀写出下列反应的化学式或名称:
AAl、BNaOH、CCl2或H2、DH2或Cl2、ENaAlO2、FHCl、GAlCl3或Al(OH)3.
以上物质中,属于共价化合物的是HCl、AlCl3.
分析 电解食盐(NaCl)水能产生B、C、D为Cl2、H2、NaOH中的某一种,C与D能产生酸溶液,则C、D应为氢气与氯气,由此确定B为碱,A是第三周期一种金属元素的单质,能与B反应生成E,E与酸F反应产物与酸的量有关,由此可确定A含有铝元素,由题各物质转化关系可推断各物质种类,据此答题;
解答 解:电解食盐(NaCl)水能产生B、C、D为Cl2、H2、NaOH中的某一种,C与D能产生酸溶液,则C、D应为氢气与氯气,生成F为HCl,由此确定B为碱,则B为NaOH,A是第三周期一种金属元素的单质,能与B反应生成E,E与酸F反应产物与酸的量有关,由此可确定A含有铝元素,则A为Al,铝与氢氧化钠反应生成E为NaAlO2,G为可溶性盐时,则G为AlCl3,G为沉淀时,则G为Al(OH)3,综上分析可知,A为Al,B为NaOH,C为Cl2或H2,D为H2或Cl2,E为NaAlO2,F为HCl,G为AlCl3或Al(OH)3,其中HCl、AlCl3属于共价化合物,
故答案为:Al;NaOH;Cl2或H2;H2或Cl2;NaAlO2;HCl;AlCl3或Al(OH)3;HCl、AlCl3.
点评 本题考查元素化合物的特性和反应,主要涉及氯碱工业、铝元素及其化合物的知识,难度不大,能根据题眼正确判断化合物是解本题的关键,注意元素化合物知识的灵活运用.

练习册系列答案
相关题目
13.在一密闭容器中进行如下反应:2SO2(气)+O2(气)═2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A. | SO2为0.5mol/L、O2为0.2mol/L | B. | SO2为0.25mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.4mol/L |
20.下列各组元素的气态氢化物的稳定性由弱到强的一组是( )
| A. | F、Cl、Br | B. | N、O、F | C. | S、Cl、Br | D. | P、O、N |
10.下列有关说法正确的是( )
| A. | 在研究物质微观结构的过程中,科学家先后使用了扫描隧道显微镜、光学显微镜、电子显微镜等观测仪器 | |
| B. | “纳米铜”具有非常强的化学活性,在空气中可以燃烧,因为它比铜片更易失去电子 | |
| C. | 室温离子液体是指在室温或接近室温下呈现的完全由阴、阳离子所组成的盐,(C2H5NH3)NO3可能是其中一种 | |
| D. | 肼、氨、甲醇燃料电池的热值远高于燃料普通燃烧的热值 |
14.将20gM物质、5gN物质、9gR物质混合加热发生化学反应,经充分反应后的混合物中含5gM物质、20gR物质还含有一种新物质Q.若M、N、R、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是( )
| A. | M+N=Q+R | B. | M+2N=2R+Q | C. | 2M+N=2R+Q | D. | 2M+N=R+2Q |
20.下列说法不正确的是( )
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链含4个碳原子的结构有2种,则与其碳原子个数相同且主链有4个碳原子的单烯烃有4种 | |
| C. | 1mol 与NaOH溶液反应,最多消耗5molNaOH 与NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molβ-紫罗兰酮(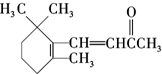 )与1molBr2发生加成反应得到3种不同产物 )与1molBr2发生加成反应得到3种不同产物 |
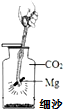 《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.
《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.