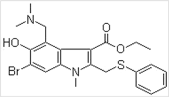
题目内容
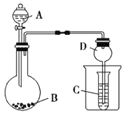
【题目】工业上联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。 实验过程中取样测丙溶液的 pH 值,pH 试纸显红色。下列有关说法正确的是

A.a 电极的电极反应式为:2H+ + 2e- = H2↑
B.联合生产过程中需添加补充 Na2SO4
C.离子交换膜 d 为阴离子交换膜
D.每转移 0.1 mol 电子,产生 1.12 L 的气体乙
【答案】B
【解析】
根据题干信息,实验过程中取样测丙溶液的pH值,pH试纸显红色,说明并溶液呈酸性,电解过程中,OH-离子在a极放电,失去电子,所以a极为阳极,电极反应式为4OH--4e-=2H2O+O2↑,即气体甲为氧气,SO42-向阳极移动,则c为阴离子交换膜,产物丙为硫酸,则b为阴极,电极反应式为2H++2e-=H2↑,即气体乙为氢气,Na+向阴极移动,则d为阳离子交换膜,产物丁为NaOH,据此分析解答问题。
A.根据上述分析可知,a极为阳极,电极反应式为4OH--4e-=2H2O+O2↑,A选项错误;
B.电解过程中Na2SO4不断减少,所以联合生产过程中需添加补充Na2SO4,B选项正确;
C.由上述分析,d为阳离子交换膜,C选项错误;
D.未指明标准状况下,不能准确计算产生的氢气的体积,D选项错误;
答案选B。

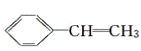
【题目】苯甲酸(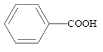 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(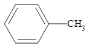 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
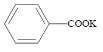 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
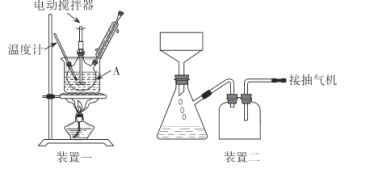
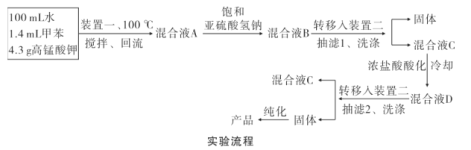
实验装置(部分夹持装置已略去)和流程如下:
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。