题目内容
【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。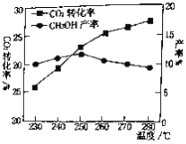
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
【答案】 a-3b+c 250℃ BD 0.08mol·L-1·min-1 < 合成尿素的反应为放热反应,温度升高,平衡逆向移动,K减小 2×10-4 2Co3++HCOOH=CO2↑+2Co2++2H+ 不变
【解析】 (1)已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。则①CH3OH(g)+O2(g) CO2(g)+2H2O(l)△H1=-akJ/mol,②H2(g) +![]() O2(g)=H2O(l)△H=-bkJ/mol,③H2O(g)= H2O(l) △H=-ckJ/mol,根据盖斯定律,将②×3-①-③得:CO2(g)+3H2(g)
O2(g)=H2O(l)△H=-bkJ/mol,③H2O(g)= H2O(l) △H=-ckJ/mol,根据盖斯定律,将②×3-①-③得:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H= (a-3b+c)kJ/mol,故答案为:a-3b+c;
CH3OH(g)+H2O(g)△H= (a-3b+c)kJ/mol,故答案为:a-3b+c;
(2)根据图像,在250℃时,甲醇的产率较高,获取CH3OH最适宜的温度是250℃;A.使用催化剂,平衡不移动,不能提高CO2转化为CH3OH的平衡转化率,错误;B.增大体系压强,平衡正向移动,有利于提高CO2转化为CH3OH的平衡转化率,正确;C.增大CO2和H2的初始投料比,可以提高氢气的转化率,但二氧化碳的转化率减小,错误;D.投料比不变和容器体积不变,增加反应物的浓度,平衡正向移动,可以提高CO2转化为CH3OH的平衡转化率,正确;故选BD,故答案为:250℃;BD;
(3)①5min时,NH3的转化率为80%,则0-5min时,NH3的转化量为△c=![]() =0.8mol/L,则NH3的消耗速率为v(NH3)=
=0.8mol/L,则NH3的消耗速率为v(NH3)=![]() =
=![]() =0.16mol/(Lmin),根据化学反应速率之比等于化学计量数之比,则CO的消耗速率为v(CO)=
=0.16mol/(Lmin),根据化学反应速率之比等于化学计量数之比,则CO的消耗速率为v(CO)=![]() v(NH3)=0.08mol/(Lmin),故答案为:0.08mol/(Lmin);
v(NH3)=0.08mol/(Lmin),故答案为:0.08mol/(Lmin);
②反应为放热反应,温度升高不利于反应正向进行,正反应进行程度随温度的升高而降低,所以K1<126.5,判断理由是:合成尿素的反应为放热反应,温度升高,平衡逆移,K减小,故答案为:<;合成尿素的反应为放热反应,温度升高,平衡逆移,K减小;
(4)①浓度均为0.1mol/L的HCOOH和HCOONa混合溶液pH=3.7,溶液中平衡时c(HCOOH)=c(HCOO-),c(H+)=10-3.7mol/L,所以HCOOH的电离常数Ka= =10-3.7=2×10-4,故答案为:2×10-4;
=10-3.7=2×10-4,故答案为:2×10-4;
②用电化学可消除HCOOH对水质造成的污染的原理为电解CoSO4、稀硫酸和HCOOH的混合溶液,将Co2+氧化为Co3+,Co3+再将HCOOH氧化成CO2,电解池中该电极上发生失电子的氧化反应,电极反应为:Co2+-e-═Co3+,Co3+氧化HCOOH生成二氧化碳,反应的离子方程式为2Co3++HCOOH=CO2↑+2Co2++2H+,忽略体积变化,电解前后Co2+的浓度不发生变化,故答案为:2Co3++HCOOH=CO2↑+2Co2++2H+;不变。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案