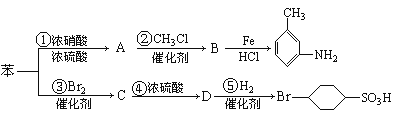
题目内容
【题目】以环已醇( ![]() )为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
)为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
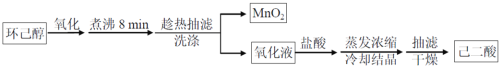
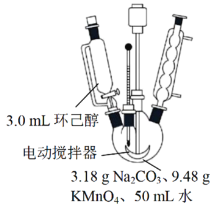
其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为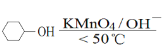 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0
(1)“氧化”过程应采用___________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
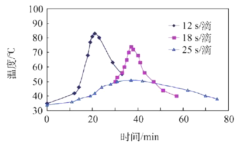
(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.
(4)“趁热抽滤”后,用________进行洗涤。
(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g 水 | 1.44 | 35.1 | 33.3 |
A.5mL B. 10mL C. 15mL D. 20mL
(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000 mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.
①NaOH溶液应装于_______ (填仪器名称).
②己二酸样品的纯度为___________.
【答案】A 25 未出现紫红色 热水 C 碱性滴定管 98.5%
【解析】
(1)由题可知,“氧化”过程中反应温度为35℃,因此应采用热水浴加热,
故答案为:A;
(2)为保证反应温度的稳定性(小于50℃),由图可知,最好采用25s/滴,
故答案为:25;
(3)0.031mol环己醇完全氧化为KOOC(CH2)4COOK,失去电子0.031mol×8=0.248mol,而0.06mol高锰酸钾在碱性条件下完全反应转移电子0.18mol(KMnO4→MnO2),由此可知,高锰酸钾先消耗完,若证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到未出现紫红色,则说明已经完成,
故答案为:未出现紫红色;
(4)趁热抽滤后,应用热水进行洗涤,
故答案为:热水;
(5)溶液中杂质KCl的质量为:0.06mol×(39+35.5)g/mol=4.47g,完全溶解KCl所需水的体积为:![]() mL=13.42mL,当杂质全部溶解在水中时,己二酸能够最大限度析出,故应浓缩溶液体积至15mL,
mL=13.42mL,当杂质全部溶解在水中时,己二酸能够最大限度析出,故应浓缩溶液体积至15mL,
故答案为:C;
(6)NaOH溶液应装于碱式滴定管;由HOOC(CH2)4COOH+2NaOH=2H2O+NaOOC(CH2)4COONa可知,n(NaOH)=![]() n(HOOC(CH2)4COOH),故己二酸样品的纯度为
n(HOOC(CH2)4COOH),故己二酸样品的纯度为![]() =98.5%,
=98.5%,
故答案为:碱式滴定管;98.5%。

【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应
【题目】对如表实验现象或操作的解释或结论错误的是![]()
编号 | 现象或操作 | 解释或结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入 |
|
B | 在 | 盐类水解反应是吸热反应 |
C | 向少量火柴头的浸泡溶液中滴加 | 火柴头里含有氯元素 |
D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
A.AB.BC.CD.D