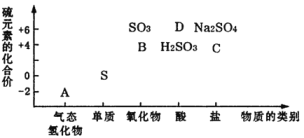
题目内容
【题目】除去下列物质中所含少量杂质的方法正确的是( )
选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
A | 苯 | 甲苯 | 酸性高锰酸钾溶液和 | 分液 |
B | 苯 | 苯酚 | 浓溴水 | 过滤 |
C | 乙醛 | 乙酸 |
| 分液 |
D | 乙烷 | 乙烯 | 氢气 | 催化剂、加热 |
A.AB.BC.CD.D
【答案】A
【解析】
A. 酸性高锰酸钾溶液可以将甲苯氧化为苯甲酸,再用NaOH溶液将苯甲酸转化为水溶性的苯甲酸钠,通过分液的方式就可将其除去,A项正确;
B.溴和三溴苯酚都能溶于苯,因此会引入新杂质;应用NaOH溶液,将苯酚转化为水溶性的苯酚钠,再进行分液即可,B项错误;
C.乙醛也能溶于水,因此无法用分液的方式将其与水溶液分离;应当在加入NaOH水溶液后,采用蒸馏的方法对乙醛进行提取即可,C项错误;
D.若通入过量的氢气会引入新的杂质,D项错误;
答案选A。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
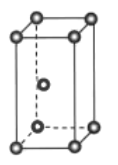
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
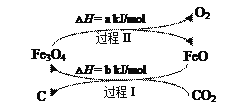
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①己知该反应可以自发进行,则△
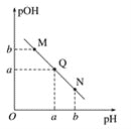
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
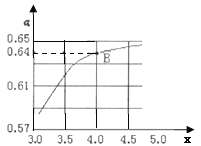
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。