题目内容
【题目】氮的固定对工农业及人类生存具有重大意义。
合成氨是最重要的人工固氮:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)下列关于该反应的说法中,正确的是___________(填正确选项字母编号)。
A.反应达到平衡状态时,N2、H2、NH3的体积比为1∶3∶2
B.加催化剂可以加快正反应速率,减慢逆反应速率
C.高温既有利于加快反应速率也有利于提高氨气的产率
D.高压既有利于加快反应速率也有利于提高氨气的产率
(2)一定温度下,在容积为1L的密闭容器中,加入lmolN2和3mol H2,反应达到平衡时H2的转化率为60%,此时反应消耗N2物质的量为___________mol;保持容器体积不变,再向容器中加入1molN2,3mol H2,反应再次达到平衡时,氢气的转化率将___________(填“增大”或“减小”或“不变”)。
(3)标准状况下,将22.4 mL的氨气通入100 mL 0.01 mol·L-1的盐酸中,充分反应后,溶液中各离子浓度由大到小的顺序是________________________。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学反应方程式为____________________。
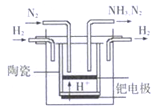
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递 H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如图所示,写出阴极的电极反应式____________________。
【答案】 D 2.08 增大 c(Cl-)>c(NH4+)>c(H+)>c(OH-) CaSO4+CO2+2NH3+H2O=CaCO3+(NH4)2SO4 N2+6e-+6H+=2NH3
【解析】(1)A.a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故A错误;B.催化剂能同等程度加快正反应和逆反应速率,故B错误;C.高温既有利于加快反应速率,但此时平衡逆向移动,不利于提高氨气的产率,故C错误;D.高压可以加快反应速率,也能促进平衡正向移动,有利于提高氨气的产率,故D正确;答案为D。
(2)根据 N2(g)+3H2(g)2NH3(g)氢气的变化量为1.8mol,则反应消耗N2物质的量为1.8mol×![]() =0.6mol;保持容器体积不变,再向容器中加入lmolN2,3molH2,相当于在2L容器中加入2molN2、6molH2反应达到平衡时再缩小体积到1L,此时平衡正向移动,氢气的转化率增大;
=0.6mol;保持容器体积不变,再向容器中加入lmolN2,3molH2,相当于在2L容器中加入2molN2、6molH2反应达到平衡时再缩小体积到1L,此时平衡正向移动,氢气的转化率增大;
(3)标准状况下,若将22.4mL的氨气通入100mL0.01mol/L的盐酸中得到NH4Cl溶液,NH4+的水解使得溶液显酸性,即c(H+)>c(OH-),再结合溶液中的电荷守恒可知溶液中各离子浓度的顺序由大到小为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,可得到碳酸钙沉淀,同时过滤得滤液为(NH4)2SO4溶液,发生反应的化学方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;
(5)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案


