��Ŀ����
����Ŀ��ijС��ͬѧ�о��ϳɰ���Ӧ����ˮ���������£�
��1����֪��N2(g)+3H2(g)=2NH3(g) ��H ����92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H ����483.6kJ/mol
������ȫȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ__________________________��
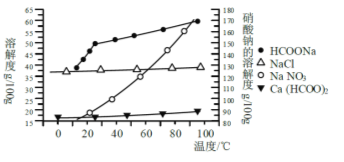
��2����ͼ�Ǻϳɰ���Ӧƽ��������NH3������������¶Ȼ�ѹǿ�仯�����ߣ�ͼ��L��L1��L2����X�ֱ�����¶Ȼ�ѹǿ������X��������_______________����¶ȡ���ѹǿ�������ж�L1��L2�Ĵ�С��ϵ��L1______L2���<����>������

��3����֪��������ͭ��Һ�м���Ũ��ˮ������������ɫ�ļ�ʽ����ͭ��������ˮ����ʱ�˳����ܽ⣬�õ�����ɫ���İ���ͭ(��)�����ӣ����������ӷ�Ӧ���£�
a��2Cu2++ 2NH3��H2O+ SO42��=== 2NH4+ + Cu2(OH)2SO4��
b��Cu2(OH)2SO4 + 8 NH3![]() 2[Cu(NH3)4]2++SO42��+2 OH��
2[Cu(NH3)4]2++SO42��+2 OH��
ijС���������ʵ�飺
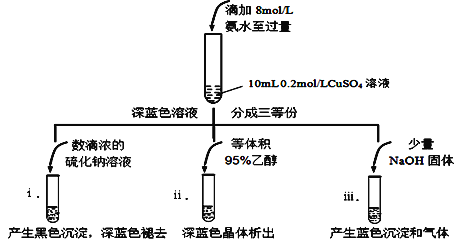
���Թܢ��з�Ӧ�����ӷ���ʽ_______________________________________��
���Թܢ��е�����ɫ������[Cu(NH3)4]SO4��H2O����ʵ������ӳ���þ����������______��
�����Ϸ���ʽ�����Թܢ���������NaOH�������ɫ�����������ԭ��_______��
���𰸡� 4NH3(g) +3O2(g) =2N2(g) +6H2O(g) ��H =��1266 kJ/mol ѹǿ �� [Cu(NH3)4]2++S2��===CuS��+4 NH3�� ��ͬ�¶��£��þ�����ˮ���ܽ�ȴ������Ҵ��е��ܽ�� Cu2(OH)2SO4+8 NH3![]() 2[Cu(NH3)4]2++SO42��+2 OH��������NaOH��ʹc(OH��)Ũ������ƽ�������ƶ���������ɫ��������������
2[Cu(NH3)4]2++SO42��+2 OH��������NaOH��ʹc(OH��)Ũ������ƽ�������ƶ���������ɫ��������������
����������1����������Ӧ�ֱ�Ϊ�ٺ͢ڣ����ݸ�˹���ɣ�����3-����2�ã�4NH3(g) +3O2(g) =2N2(g) +6H2O(g) ��H =��1266 kJ/mol��
��2���ϳɰ���ӦΪ���ȷ�Ӧ���������¶�ƽ�������ƶ������������������С����ͼ��ì�ܣ�������ѹǿ��ƽ���������ƶ�������������������ʸı�����Ϊѹǿ��ѹǿ��ͬʱ���¶����ߣ�ƽ�������ƶ����������������С��L1��L2��
��3��������֪������ɫ��Һ����[Cu(NH3)4]2+���μ�Na2S��Һ�����ɺ�ɫ����ӦΪCuS������ԭ���غ㣬ͬʱ�ų����������ӷ���ʽΪ��[Cu(NH3)4]2++S2��=CuS��+4NH3������[Cu(NH3)4]SO4��Һ�м����Ҵ�����[Cu(NH3)4]SO4��H2O����������˵����ͬ�¶��£��þ�����ˮ���ܽ�ȴ������Ҵ��е��ܽ����������֪��������ͭ��Һ�м���Ũ��ˮ������������ɫ�ļ�ʽ����ͭ��������ˮ����ʱ�˳����ܽ⣬�õ�����ɫ���İ���ͭ(��)�����ӣ����������ӷ�Ӧ���£�a��2Cu2++2NH3��H2O+SO42��= 2NH4+ + Cu2(OH)2SO4����b��Cu2(OH)2SO4 + 8 NH3![]() 2[Cu(NH3)4]2++SO42��+2OH����������Һ�д���Cu2(OH)2SO4+8NH3
2[Cu(NH3)4]2++SO42��+2OH����������Һ�д���Cu2(OH)2SO4+8NH3![]() 2[Cu(NH3)4]2++SO42��+2OH��������NaOH��ʹc(OH��)Ũ������ƽ�������ƶ���������ɫ����������������
2[Cu(NH3)4]2++SO42��+2OH��������NaOH��ʹc(OH��)Ũ������ƽ�������ƶ���������ɫ����������������