ÌâÄżÄÚÈĘ
ĄŸÌâÄżĄżÄłĐŁ»ŻŃ§ŃĐŸżĐÔŃ§Ï°ĐĄŚéČéÔÄŚÊÁÏÁ˜├ÒÔÏÂÄÚÈĘŁș
ÒÒ¶țËᣚHOOC©COOHŁŹżÉŒòĐŽÎȘH2C2O4Ł©ËŚłÆČĘËáŁŹÒŚÈÜÓÚËźŁŹÊôÓÚ¶țÔȘÖĐÇżËᣚÎȘÈő”çœâÖÊŁ©ŁŹÇÒËáĐÔÇżÓÚÌŒËᣏÆäÈÛ”ăÎȘ101.5ĄæŁŹÔÚ157ĄæÉę»ȘŁźÎȘÌœŸżČĘËá”ÄČż·Ö»ŻŃ§ĐÔÖÊŁŹœűĐĐÁËÈçÏÂÊ”ŃéŁș
Łš1Ł©ÏòÊąÓĐ1mL±„șÍNaHCO3ÈÜÒș”ÄÊÔčÜÖĐŒÓÈëŚăÁżÒÒ¶țËáÈÜÒșŁŹčÛČ씜ÓĐÎȚÉ«ÆűĆĘČúÉúŁźžĂ·ŽÓŠ”ÄÀëŚÓ·œłÌÊœÎȘ________Ł»
Łš2Ł©ÏòÊąÓĐÒÒ¶țË᱄șÍÈÜÒș”ÄÊÔčÜÖĐ”ÎÈ댞”ÎÁòËáËữ”ÄKMnO4ÈÜÒșŁŹŐń”ŽŁŹ·ąÏÖÆäÈÜÒș”ÄŚÏșìÉ«ÍÊÈ„Ł»ąÙ˔ÜÒÒ¶țËáŸßÓĐ______ŁšÌŃő»ŻĐÔĄ±ĄąĄ°»čÔĐÔĄ±»òĄ°ËáĐÔĄ±Ł©Ł»ąÚÇëĆäÆœžĂ·ŽÓŠ”ÄÀëŚÓ·œłÌÊœŁș_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2Ąü+_____H2O
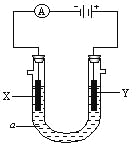
Łš3Ł©œ«Ò»¶šÁż”ÄÒÒ¶țËá·ĆÓÚÊÔčÜÖĐŁŹ°ŽÈçÍŒËùÊŸŚ°ÖĂœűĐĐÊ”Ń飚ŒĐłÖŚ°ÖĂÎŽ±êłöŁ©Łș

Ê”Ńé·ąÏÖŁșŚ°ÖĂCĄąGÖĐłÎÇćÊŻ»ÒËź±ä»ëŚÇŁŹBÖĐCuSO4·ÛÄ©±äÀ¶ŁŹFÖĐCuO·ÛÄ©±äșìĄŁŸĘŽË»ŰŽđŁș
ąÙÉÏÊöŚ°ÖĂÖĐŁŹD”ÄŚśÓĂÊÇ_________ŁŹ
ąÚÒÒ¶țËá·Öœâ”Ä»ŻŃ§·œłÌÊœÎȘ ________Ł»
Łš4Ł©žĂĐĄŚé͏ѧœ«2.52gČĘË៧Ì棚H2C2O42H2OŁ©ŒÓÈ딜100mL 0.2mol/L”ÄNaOHÈÜÒșÖĐłä·Ö·ŽÓŠŁŹČâ”Ă·ŽÓŠșóÈÜÒșłÊËáĐÔŁŹÆäÔÒòÊÇ_______ŁšÓĂÎÄŚÖŒò”„±íÊöŁ©ŁŹžĂÈÜÒșÖĐžśÀëŚÓ”ÄĆš¶ÈÓÉŽó”œĐĄ”ÄËłĐòÎȘŁș_______ŁšÓĂÀëŚÓ·ûșƱíÊŸŁ©Łź
ĄŸŽđ°žĄżHCO3-+H2C2O4=HC2O4-+CO2Ąü+H2O »čÔĐÔ 2 5 6 2 10 8 łęÈ„»ìșÏÆűÌćÖĐ”ÄCO2 H2C2O4![]() H2O+COĄü+CO2Ąü ·ŽÓŠËù”ĂÈÜÒșÎȘNaHC2O4ÈÜÒșŁŹÓÉÓÚHC2O4©”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹ”ŒÖÂÈÜÒșÖĐcŁšH+Ł©ŁŸcŁšOH©Ł©ŁŹËùÒÔÈÜÒșłÊËáĐÔ Na+ŁŸHC2O4-ŁŸH+ŁŸC2O42-ŁŸOH©
H2O+COĄü+CO2Ąü ·ŽÓŠËù”ĂÈÜÒșÎȘNaHC2O4ÈÜÒșŁŹÓÉÓÚHC2O4©”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹ”ŒÖÂÈÜÒșÖĐcŁšH+Ł©ŁŸcŁšOH©Ł©ŁŹËùÒÔÈÜÒșłÊËáĐÔ Na+ŁŸHC2O4-ŁŸH+ŁŸC2O42-ŁŸOH©
ĄŸœâÎöĄż
Łš1Ł©ÇżËáÖÆÈőËáÔÀíŁ»
Łš2Ł©ËáĐÔžßĂÌËáŒŰŸßÓĐÇżŃő»ŻĐÔŁŹČĘËáŸßÓĐ»čÔĐÔŁŹÄܱ»ËáĐÔžßĂÌËáŒŰŃő»ŻŁ»žùŸĘ”Ăʧ”çŚÓÊŰșășÍ”çșÉÊŰșăĆäÆœÀëŚÓ·œłÌÊœŁ»
Łš3Ł©H2C2O4![]() H2O+COĄü+CO2ĄüŁŹBŚ°ÖĂŃéÖ€ČúÎïËźŁŹCŚ°ÖĂŃéÖ€ČúÎïCO2ŁŹDŚ°ÖĂłę”ôCO2ŁŹEŚ°ÖĂłę”ôËźŐôÆűŁŹFĄąGŚ°ÖĂŃéÖ€ČúÎïCOŁŹŸĘŽË·ÖÎöĄŁ
H2O+COĄü+CO2ĄüŁŹBŚ°ÖĂŃéÖ€ČúÎïËźŁŹCŚ°ÖĂŃéÖ€ČúÎïCO2ŁŹDŚ°ÖĂłę”ôCO2ŁŹEŚ°ÖĂłę”ôËźŐôÆűŁŹFĄąGŚ°ÖĂŃéÖ€ČúÎïCOŁŹŸĘŽË·ÖÎöĄŁ
Łš4Ł©ÍščęŒÆËă·ŽÓŠșóÈÜÒșÎȘNaHC2O4ÈÜÒșŁŹžùŸĘ·ŽÓŠșóÈÜÒșłÊËáĐÔŁŹżÉÖȘHC2O4- ”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹÓÉŽËÈ·¶šÈÜÒșÖĐžśÀëŚÓĆš¶È”œŽóĐĄĄŁ
Łš1Ł©ÒÒ¶țËáÖĐșŹÓĐôÈ»ùŁŹŸßÓĐËáĐÔŁŹËáĐÔ±ÈÌŒËáÇżŁŹÓëÌŒËáÇâÄÆ·ŽÓŠÉúłÉ¶țŃő»ŻÌŒșÍÒÒËáÄÆŁŹžĂ·ŽÓŠ”ÄÀëŚÓ·œłÌÊœÎȘŁșHCO3-+H2C2O4=HC2O4-+CO2Ąü+H2OŁ»
Žđ°žŁșHCO3-+H2C2O4=HC2O4-+CO2Ąü+H2OŁ»
Łš2Ł©ËáĐÔKMnO 4 ÈÜÒșŸßÓĐÇżŃő»ŻĐÔŁŹÏòÊąÓĐÉÙÁżÒÒ¶țË᱄șÍÈÜÒș”ÄÊÔčÜÖĐ”ÎÈëÓĂÁòËáËữ”ÄKMnO 4ÈÜÒșŁŹŐń”ŽŁŹ·ąÏÖÆäÈÜÒș”ÄŚÏșìÉ«ÍÊÈ„ŁŹË”ĂśÒÒ¶țËá±»ËáĐÔžßĂÌËáŒŰŃő»ŻŁŹŸßÓĐ»čÔĐÔŁ»žùŸĘŃő»Ż»čÔ·ŽÓŠ·œłÌÊœ”ÄĆäÆœÔÔòŁș”Ăʧ”çŚÓÊŰș㥹ÖÊÁżÊŰșășÍ”çșÉÊŰșăĆäÆœžĂ·ŽÓŠ”ÄÀëŚÓ·œłÌÊœŁș2MnO 4 - +5 H2C2O4 +6H + =2Mn 2+ +10CO 2 Ąü+8H2OŁ»
Žđ°žŁș»čÔĐÔ 2 5 6 2 10 8
Łš3Ł©ŒÓÈÈÒÒ¶țËᣏ·ŽÓŠÎïÍšÈëBŁŹÊčCuSO 4 ·ÛÄ©±äÀ¶ŁŹË”ĂśÓĐËźÉúłÉŁŹŚ°ÖĂCÖĐłÎÇćÊŻ»ÒËź±ä»ëŚÇŁŹË”ĂśÓжțŃő»ŻÌŒÉúłÉŁ»Ś°ÖĂDÖжțŃő»ŻÌŒșÍÇâŃő»ŻÄÆ·ŽÓŠłęÈ„»ìșÏÆűÌćÖДĶțŃő»ŻÌŒŁŹFÖĐCuO·ÛÄ©±äșìĄąGÖĐłÎÇćÊŻ»ÒËź±ä»ëŚÇ˔ÜÓĐÒ»Ńő»ŻÌŒÉúłÉŁŹËùÒÔÒÒ¶țËá”Ä·ÖœâČúÎïÎȘCOĄąCO 2 ĄąH2OŁ»
Žđ°žŁșłęÈ„»ìșÏÆűÌćÖĐ”ÄCO2Ł» H2C2O4![]() H2O+COĄü+CO2ĄüŁ»
H2O+COĄü+CO2ĄüŁ»
Łš4Ł©ąÙ2.52gČĘË៧Ìć”ÄÎïÖÊ”ÄÁż= ![]() =0.02molŁŹ100mL 0.2mol/L”ÄNaOHÈÜÒșÖĐÇâŃő»ŻÄÆ”ÄÎïÖÊ”ÄÁż=100mLĄÁ10 -3 L/mLĄÁ0.2mol/L=0.02molŁ»ËùÒÔ·ŽÓŠÉúłÉNaHC2O4 ŁŹËù”ĂÈÜÒșÎȘNaHC2O4ÈÜÒșŁŹÓÉÓÚHC2O4 - ”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹ”ŒÖÂÈÜÒșÖĐcŁšH + Ł©ŁŸcŁšOH - Ł©ŁŹËùÒÔÈÜÒșłÊËáĐÔŁ»
=0.02molŁŹ100mL 0.2mol/L”ÄNaOHÈÜÒșÖĐÇâŃő»ŻÄÆ”ÄÎïÖÊ”ÄÁż=100mLĄÁ10 -3 L/mLĄÁ0.2mol/L=0.02molŁ»ËùÒÔ·ŽÓŠÉúłÉNaHC2O4 ŁŹËù”ĂÈÜÒșÎȘNaHC2O4ÈÜÒșŁŹÓÉÓÚHC2O4 - ”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹ”ŒÖÂÈÜÒșÖĐcŁšH + Ł©ŁŸcŁšOH - Ł©ŁŹËùÒÔÈÜÒșłÊËáĐÔŁ»
ąÚÁœŐßŐęșĂ1Łș1·ŽÓŠÉúłÉNaHC2O4ŁŹÈÜÒșÏÔËáĐÔŁŹË”ĂśHC2O4 - ”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹ¶űÈÜÒșÖĐ»čŽæÔÚŚĆËź”Ä”çÀ룏čÊH+ŁŸC2O42-ŁŹÓÉÓÚÀëŚÓ”Ä”çÀëłÌ¶ÈœÏĐĄŁŹÔòÓĐHC2O4-ŁŸH+ŁŹÀëŚÓĆš¶ÈÓÉŽó”œĐĄ”ÄËłĐòÎȘNa+ŁŸHC2O4-ŁŸH+ŁŸC2O42-ŁŸOH©Ł»
Žđ°žŁș·ŽÓŠËù”ĂÈÜÒșÎȘNaHC2O4ÈÜÒșŁŹÓÉÓÚHC2O4©”Ä”çÀëłÌ¶È±ÈËźœâłÌ¶ÈŽóŁŹ”ŒÖÂÈÜÒșÖĐcŁšH+Ł©ŁŸcŁšOH©Ł©ŁŹËùÒÔÈÜÒșłÊËáĐÔ Na+ŁŸHC2O4-ŁŸH+ŁŸC2O42-ŁŸOH©