题目内容
下列溶液中微粒浓度关系一定正确的是( )
| A、某温度下测得CH3COONa和CH3COOH混合溶液pH=7,则c(Na+)=c(CH3COO-) |
| B、0.1mol/L NH4HS溶液:c(NH4+)<c(HS-)+c(H2S)+c(S2-) |
| C、等浓度等体积的NH4Cl和HCl的混合溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、相同条件下,浓度相同的Na2CO3、C6H5ONa、CH3COONa和NaOH溶液,其pH关系为:pH (Na2CO3)>pH (CH3COONa)>pH (C6H5ONa)>pH (NaOH) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.混合溶液pH=7,不能说明该溶液呈中性,溶液呈存在电荷守恒;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.等浓度等体积的NH4Cl和HCl的混合溶液中,溶液呈酸性,则c(H+)>c(OH-),溶液中存在铵根离子水解;
D.相同条件下,浓度相同的Na2CO3、C6H5ONa、CH3COONa和NaOH溶液,氢氧化钠溶液的pH最大,酸根离子水解程度越大,其相应钠盐溶液pH越大.
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.等浓度等体积的NH4Cl和HCl的混合溶液中,溶液呈酸性,则c(H+)>c(OH-),溶液中存在铵根离子水解;
D.相同条件下,浓度相同的Na2CO3、C6H5ONa、CH3COONa和NaOH溶液,氢氧化钠溶液的pH最大,酸根离子水解程度越大,其相应钠盐溶液pH越大.
解答:
解:A.混合溶液pH=7,不能说明该溶液呈中性,根据电荷守恒知,不能确定溶液中是否存在c(Na+)=c(CH3COO-),故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(NH4+)+c(NH3.H2O)=c(HS-)+c(H2S)+c(S2-),所以c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B正确;
C.等浓度等体积的NH4Cl和HCl的混合溶液中,溶液呈酸性,则c(H+)>c(OH-),铵根离子水解、HCl电离导致溶液中c(NH4+)<c(H+),故C错误;
D.相同条件下,浓度相同的Na2CO3、C6H5ONa、CH3COONa和NaOH溶液,氢氧化钠溶液的pH最大,酸根离子水解程度越大,其相应钠盐溶液pH越大,酸根离子水解程度CO32->C6H5O->CH3COO-,所以pH大小顺序是pH (NaOH)>pH (Na2CO3)>pH (C6H5ONa)>pH (CH3COONa),故D错误;
故选B.
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(NH4+)+c(NH3.H2O)=c(HS-)+c(H2S)+c(S2-),所以c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B正确;
C.等浓度等体积的NH4Cl和HCl的混合溶液中,溶液呈酸性,则c(H+)>c(OH-),铵根离子水解、HCl电离导致溶液中c(NH4+)<c(H+),故C错误;
D.相同条件下,浓度相同的Na2CO3、C6H5ONa、CH3COONa和NaOH溶液,氢氧化钠溶液的pH最大,酸根离子水解程度越大,其相应钠盐溶液pH越大,酸根离子水解程度CO32->C6H5O->CH3COO-,所以pH大小顺序是pH (NaOH)>pH (Na2CO3)>pH (C6H5ONa)>pH (CH3COONa),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性再结合守恒思想分析解答,易错选项是A,注意pH=7的溶液不一定是中性溶液,为易错点.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
将一小块钠放入CuSO4溶液中,观察到现象是( )
| A、钠溶解,有Cu析出,并有气体产生 |
| B、钠溶解,有蓝色沉淀,有氢气产生 |
| C、有气体产生,无沉淀产生 |
| D、钠在液面逐渐消失,有气体产生和蓝色沉淀 |
下列有关实验说法不正确的是( )
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,检验火柴头中的氯元素 |
| C、在2mL紫色的CoCl2溶液中加入浓盐酸,可使溶液显蓝色 |
| D、制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能将溶液全部蒸干 |
下列说法正确的是( )
| A、同一原子中,4S、2P、4P能级的轨道数依次增多 |
| B、3P2表示3P能级有两个轨道 |
| C、处于最低能量的原子叫做基态原子 |
| D、同一原子中,1S、2S、3S电子的能量逐渐减小 |
某高聚物的结构片段如下:
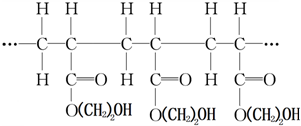
下列分析正确的是( )

下列分析正确的是( )
| A、它是缩聚反应的产物 |
| B、其单体是CH2=CH2COOH和HOCH2CH2OH |
| C、其链节是CH3CH2COO(CH2)2OH |
| D、其单体是CH2=CHCOO(CH2)2OH |
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A、第一电离能:③>①>② |
| B、原子半径:③>②>① |
| C、电负性:③>①>② |
| D、最高正化合价:③>②>① |
 在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应:
在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应: