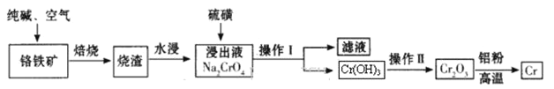
题目内容
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是(_____)
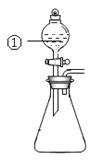
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C. | 硫酸亚铁溶液 | 过氧化钠 | 形成黄色溶液 |
D. | 硫酸铁溶液 | 氢硫酸溶液 | 产生黄色浑浊 |
A. A B. B C. C D. D
【答案】D
【解析】稀盐酸优先与氢氧化钠反应,故不会立即产生气泡,A项错误;氯化铝溶液滴入浓氢氧化钠溶液,因开始氯化铝为少量,氢氧化钠过量,发生的反应为Al3++4OH—=AlO2—+2H2O,故不会立即产生大量白色沉淀,B项错误;硫酸亚铁溶液滴入过氧化钠中,发生的反应为:2H2O+2Na2O2=4NaOH+O2↑、2NaOH+FeSO4=Fe(OH)2↓+ Na2SO4、、4Fe(OH)2+O2+2H2O=4Fe(OH)3,C项错误;硫酸铁溶液滴入氢硫酸溶液的反应:2Fe3++S2—= 2Fe2++S↓,D项正确。

【题目】化学实验是学习理解化学知识的基础,它以其生动的魅力和丰富的内涵在化学学习中发挥着独特的功能和作用。请回答下列问题:
I .实验室欲用固体NaOH配制100 mL 1mol·L-1的NaOH溶液。
(1)配制上述溶液,下列不能用到的仪器是____________________(用序号回答)。
A.烧杯 B.大试管 C.胶头滴管 D.100 mL容量瓶
(2)除上述仪器外,还一定要的玻璃仪器有______________。
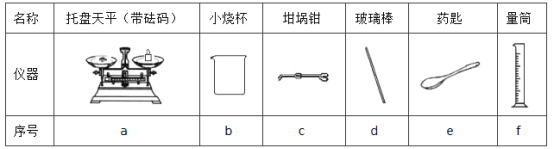
(3)用托盘天平称取NaOH固体的质量为_________g,从下表中选择称量NaOH固体所需要的仪器 __________________(填序号)。
(4)下列情况使所配得溶液的浓度如何变化?(填“偏高”“ 偏低”或“不变”)
A.未洗涤溶解氢氧化钠的烧杯_________。
B.容量瓶使用前用蒸馏水洗过,内壁附有水珠而未干燥处理___________。
C.定容时加水超过了刻度线,将多出的液体吸出___________。
D.定容时俯视容最瓶读数___________。
II.已知化合物甲和乙都不溶于水,甲可溶于质最分数大于或等于98%的浓硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器,甲与硫酸不发生化学反应)。
请填写下列空白,完成由上述混合物得到固体甲的实验设计。
序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
① | 溶解 | 将混合物放入烧杯中,加入98% H2SO4____。 |
② | _____________ | |
③ | 稀释(沉淀) | ____________ |
④ | 过滤 | |
⑤ | _________ | 向④的过滤器中注入少量蒸馏水,使水面浸过沉淀物,待水滤出后,再次加水洗涤,连洗几次。 |
⑥ | 检验沉淀是否洗净 | ____________________。 |