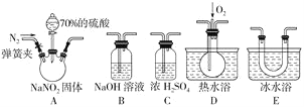
��Ŀ����
����Ŀ��ij���жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5(ֱ��С�ڵ���2.5��m������������)������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1��PM2.5��ɢ�ڿ������γɵķ�ɢϵ__(����������������������)���塣
��2����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���ݱ��������жϴ�������Ϊ__(����������������)�ԣ���ʾ����������Ե�c(H��)��c(OH��)=__mol��L-1��
��3��úȼ���ŷŵ���������SO2��NOx���γ����꣬��Ⱦ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�������ж������������̵����ӷ���ʽ��
__ClO2-��__NO��__=__Cl-��__NO3-��__
��4��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ��__��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ�����__(����ĸ)��
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
��5������β����NOx��CO�����ɼ�ת����
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��д������������NO�Ļ�ѧ����ʽ��__��
������ȼ�Ͳ���ȫȼ��ʱ����CO��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ__��
���𰸡������� �� 10-4 3 4 4OH- 3 4 2H2O C��H2O(g)![]() CO��H2 ab N2+O2
CO��H2 ab N2+O2![]() 2NO 2CO+2NO
2NO 2CO+2NO![]() 2CO2+N2
2CO2+N2
��������
��1������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��
��2���۲�����з������к���![]() ��
��![]() ˮ�������ԣ�PM2.5��Ϊ���ԣ�
ˮ�������ԣ�PM2.5��Ϊ���ԣ�
��3����Ӧ��NԪ�ػ��ϼ���+2�۵�NO����Ϊ![]() ��+5�ۣ�������3�ۣ�ClԪ����
��+5�ۣ�������3�ۣ�ClԪ����![]() ��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����
��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����![]() ϵ��Ϊ3����NOϵ��Ϊ4�����õ���غ㼰Ԫ���غ���ƽ���ʵ�ϵ����
ϵ��Ϊ3����NOϵ��Ϊ4�����õ���غ㼰Ԫ���غ���ƽ���ʵ�ϵ����
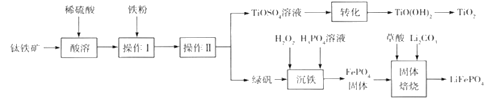
��4����̼��ˮ������Ӧ����һ����̼���������ڶ�������Ϊ������������ն���������Լ��Ͷ�����������Ӧ��
��5�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ������������NO�ǿ����е����������ŵ�����һ����������������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ��һ����̼��һ�����������������ɵ����Ͷ�����̼��
��1������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��PM2.5��ָ������ֱ���ӽ���2.5��106m�Ŀ����ֱ������100nm����ϸ�������ɢ�ڿ������γɵķ�ɢϵ���ǽ��壬
�ʴ�Ϊ�������ڣ�
��2���۲�����з���![]() ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ����õ���
ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ����õ���![]() ����������ֵ��������ʽ�ӿɵ�c(H+)=1.0��104mol/L��������Ũ��Ϊ104mol/L��
����������ֵ��������ʽ�ӿɵ�c(H+)=1.0��104mol/L��������Ũ��Ϊ104mol/L��
�ʴ�Ϊ���104��
��3����Ӧ��NԪ�ػ��ϼ���+2�۵�NO����Ϊ![]() ��+5�ۣ�������3�ۣ�ClԪ����
��+5�ۣ�������3�ۣ�ClԪ����![]() ��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����
��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����![]() ϵ��Ϊ3����NOϵ��Ϊ4������ݵ���غ㡢Ԫ���غ㼰��Ӧ�ڼ��������½��У�����ƽ�õķ���ʽΪ��
ϵ��Ϊ3����NOϵ��Ϊ4������ݵ���غ㡢Ԫ���غ㼰��Ӧ�ڼ��������½��У�����ƽ�õķ���ʽΪ��![]() ��
��
�ʴ�Ϊ��3��4��4OH��3��4��2H2O��
��4���ٽ�̿��ˮ������Ӧ����ˮú���Ļ�ѧ����ʽΪ��C��H2O(g)![]() CO��H2��
CO��H2��
�ʴ�Ϊ��C��H2O(g)![]() CO��H2��
CO��H2��
��a������������������������Ծ��������������ͨ�ԣ��ܹ���Ӧ��SO2+Ca(OH)2=CaSO3��+H2O����a��ȷ��
b����������ˮ��Һ�������ᣬ����Ҳ�ܹ���̼���Ʒ�Ӧ��SO2+Na2CO3=Na2SO3+CO2�������Կ�����̼������Һ��ϴ�Ӽ�����b��ȷ��
c�������������Ȼ�����Һ����Ӧ����c����
d��SO2��������������Һ�е��ܽ�Ⱥ�С�����Բ�����������������Һ��ϴ��Һ����d����
�ʴ�Ϊ��ab��
��5���٣�����������NO�ǿ����е����������ŵ�����һ����������Ӧ�Ļ�ѧ����ʽΪ��N2+O2![]() 2NO��
2NO��
�ʴ�Ϊ��N2+O2![]() 2NO��
2NO��
�ڣ�������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ��һ����̼��һ�����������������ɵ����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��
�ʴ�Ϊ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��

 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
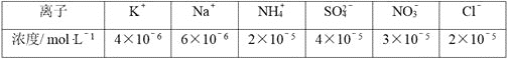
��ѧ����ϵ�д�����Ŀ��ij�¶��£�H2 (g)��CO2 (g) ![]() CO(g)��H2O(g)��ƽ�ⳣ��K��9/4�����¶����ڼס��ҡ���������ͬ�ĺ����ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�����±���ʾ�������жϲ���ȷ����
CO(g)��H2O(g)��ƽ�ⳣ��K��9/4�����¶����ڼס��ҡ���������ͬ�ĺ����ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�����±���ʾ�������жϲ���ȷ����
��ʼŨ�� | �� | �� | �� |
c(H2)/ mol��L-1 | 0.010 | 0.020 | 0.020 |
c(CO2)/ mol��L-1 | 0.010 | 0.010 | 0.020 |
A.ƽ��ʱ������CO2��ת���ʴ���60%
B.ƽ��ʱ���ͱ���H2��ת���ʾ���60��
C.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
D.ƽ��ʱ������c(CO��)�Ǽ��е�2������0.012 mol��L-1