题目内容
1.已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中正确的是( )| A. | Be(OH)2可能具有两性 | |
| B. | 氯化铍中铍原子的最外层电子数是8个 | |
| C. | 氢氧化铍的碱性比氢氧化钙强 | |
| D. | 单质铍可和冷水剧烈反应产生氢气 |
分析 铍(Be)位于周期表中第2周期第ⅡA族,同周期自左而右金属性减弱,同主族自上而下金属性增强,则元素的金属性强弱的关系为:Li>Be,Na>Mg>Be,Ca>Mg>Be,金属性越强氯化物氧化性越弱,最高价氧化物对应水化物的碱性越强,越容易与水反应生成氢气,Mg与冷水的反应已是很慢了,则说明铍与冷水的反应很难进行.
解答 解:A.Be与Al位于对角线位置,氢氧化铝具有两性,则Be(OH)2可能具有两性,故A正确;
B.氯化铍中铍原子的最外层电子数是2+2=4个,故B错误;
C.金属性Ca>Mg>Be,故氢氧化钙的碱性比氢氧化铍的碱性强,故C错误;
D.金属性Mg>Be,Mg与冷水的反应已是很慢了,则铍与冷水的反应很难进行,故D错误,
故选A.
点评 本题考查元素周期表的应用,为高频考点,把握元素的位置、元素的性质及元素周期律为解答的关键,注重基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
11.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是( )
| A. | X能与某些非金属元素化合 | |
| B. | X可能为金属元素 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
12.下列说法中正确的是( )
| A. | 由Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑可知,酸性H2SiO3>H2CO3 | |
| B. | 氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中 | |
| C. | 向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解 | |
| D. | 瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置 |
9.下列式子表示的物质一定为纯净物的是( )
| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C7H16 |
16.已知①向KI溶液中通入过量Cl2会有KIO3生成;②向酸化的KI与KIO3混合液中滴加淀粉溶液会变蓝色.下列有关说法正确的是( )
| A. | Iˉ只有还原性,IO32-只有氧化性 | |
| B. | 由①②可知氧化性的强弱顺序为Cl2>I2>IO32- | |
| C. | ①中发生反应的离子方程式为:3Cl2+Iˉ+3OHˉ=IO32-+6Clˉ+3H+ | |
| D. | 反应②中若有5mol电子转移,则生成3mol单质I2 |
10.在一定条件下,科学家利用从烟道气中分离出的CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
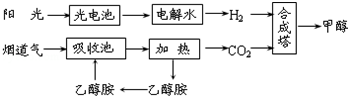
(1)该合成路线对于环境保护的价值在于减少烟道气中二氧化碳排放到空气中造成温室效应.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;.
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9KJ/mol.
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g),CH3CH2OH(g)+3H2O(g);下列叙述正确的是acd.
a.使用催化剂可能大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入过量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
(5)在一定体积的密闭容器中,CO2和H2也可以进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
①该反应为吸热反应(填“吸热”或“放热”).
②能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆
D.c(CO)=c(H2) E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为 1.5mol/L,c(CO) 为 1mol/L,c(H2O) 为 3mol/L,则下一时刻,反应向逆向移动(填“正向”“逆向”或“不”).

(1)该合成路线对于环境保护的价值在于减少烟道气中二氧化碳排放到空气中造成温室效应.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;.
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9KJ/mol.
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g),CH3CH2OH(g)+3H2O(g);下列叙述正确的是acd.
a.使用催化剂可能大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入过量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
(5)在一定体积的密闭容器中,CO2和H2也可以进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度T的关系如表所示:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为吸热反应(填“吸热”或“放热”).
②能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆
D.c(CO)=c(H2) E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为 1.5mol/L,c(CO) 为 1mol/L,c(H2O) 为 3mol/L,则下一时刻,反应向逆向移动(填“正向”“逆向”或“不”).
11.下列物质中锰元素的化合价最高的是( )
| A. | MnO2 | B. | MnCl2 | C. | K2MnO4 | D. | KMnO4 |
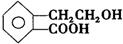 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.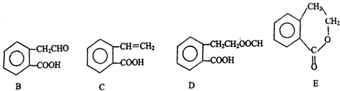
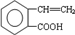 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.