题目内容
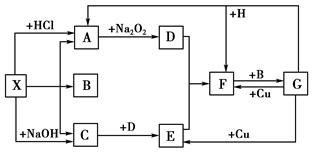
(7分)下图中A、B均为固体,其中B为固体单质。下图可用于工业生产液体F,F的消费量常被视为一个国家工业发展水平的标志。回答下列问题:

(1)A由两种元素构成,原子个数比为1:2,D为红棕色固体,A的化学式
(2)写出D与铝单质反应的化学方程式
(3)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.这10分钟内,X的平均速率是0. 1mol/( L·min)
B. 在工业生产中可以通过增加X的量来提高C的转化率
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
(4)写出标准状况下2.24L气体C与0.15mol氢氧化钠溶液反应的离子方程式

(1)A由两种元素构成,原子个数比为1:2,D为红棕色固体,A的化学式
(2)写出D与铝单质反应的化学方程式
(3)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.这10分钟内,X的平均速率是0. 1mol/( L·min)
B. 在工业生产中可以通过增加X的量来提高C的转化率
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
(4)写出标准状况下2.24L气体C与0.15mol氢氧化钠溶液反应的离子方程式
(1)FeS2(1分) (2)2Al + Fe2O3 2Fe +Al2O3
2Fe +Al2O3
(3)BD (4)2SO2+3OH- =SO32-+HSO3-+H2O
 2Fe +Al2O3
2Fe +Al2O3(3)BD (4)2SO2+3OH- =SO32-+HSO3-+H2O
(1)F的消费量常被视为一个国家工业发展水平的标志,所以F是硫酸。则E是SO3,C是SO2,X是氧气,所以B是单质S。又因为D为红棕色固体,因此D是Fe2O3,所以A中含有铁元素。由于A中原子个数比为1:2,所以A是FeS2。
(2)铝能和氧化铁发生铝热反应,方程式为2Al + Fe2O3 2Fe +Al2O3。
2Fe +Al2O3。
(3)考查可逆反应的有关计算,一般采用三段式,即
2SO2 + O2 2SO3
2SO3
起始量(mol) 4 3 0
转化量(mol) 2x x 2x
平衡量(mol) 4-2x 3-x 2x
则有4-2x+3-x+2x=6mol
解得x=1mol
所以10分钟内氧气的平均速率是 =0.05mol/( L·min),A不正确;SO2的转化率是
=0.05mol/( L·min),A不正确;SO2的转化率是 ,D正确;增大氧气的浓度,平衡向正反应方向移动,可以提高SO2的转化率,B正确;由于反应速率之比是相应的化学计量数之比,所以C和X的消耗速率比总是2:1的,C不正确,答案选BD。
,D正确;增大氧气的浓度,平衡向正反应方向移动,可以提高SO2的转化率,B正确;由于反应速率之比是相应的化学计量数之比,所以C和X的消耗速率比总是2:1的,C不正确,答案选BD。
(4)标准状况下2.24LSO2是0.1mol,氢氧化钠是0.15mol,所以生成物中既有亚硫酸钠,还有亚硫酸氢钠,且二者是1︰1的,因此方程式为2SO2+3OH- =SO32-+HSO3-+H2O。
(2)铝能和氧化铁发生铝热反应,方程式为2Al + Fe2O3
 2Fe +Al2O3。
2Fe +Al2O3。(3)考查可逆反应的有关计算,一般采用三段式,即
2SO2 + O2
 2SO3
2SO3起始量(mol) 4 3 0
转化量(mol) 2x x 2x
平衡量(mol) 4-2x 3-x 2x
则有4-2x+3-x+2x=6mol
解得x=1mol
所以10分钟内氧气的平均速率是
 =0.05mol/( L·min),A不正确;SO2的转化率是
=0.05mol/( L·min),A不正确;SO2的转化率是 ,D正确;增大氧气的浓度,平衡向正反应方向移动,可以提高SO2的转化率,B正确;由于反应速率之比是相应的化学计量数之比,所以C和X的消耗速率比总是2:1的,C不正确,答案选BD。
,D正确;增大氧气的浓度,平衡向正反应方向移动,可以提高SO2的转化率,B正确;由于反应速率之比是相应的化学计量数之比,所以C和X的消耗速率比总是2:1的,C不正确,答案选BD。(4)标准状况下2.24LSO2是0.1mol,氢氧化钠是0.15mol,所以生成物中既有亚硫酸钠,还有亚硫酸氢钠,且二者是1︰1的,因此方程式为2SO2+3OH- =SO32-+HSO3-+H2O。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目





 )
)