题目内容
【题目】下表为元素周期表的一部分,请参照元素①﹣⑩在表中的位置,回答下列问题:
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)自然界物质种类最多的元素在周期表中的位置是______
(2)⑧⑨⑩的离子半径由大到小的顺序为______(填化学用语).
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式______
(4)根据斜线性质相似规则,②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,写出该反应的离子方程式______.
【答案】第二周期第IV族S2﹣>Cl﹣>Na+![]() LiOH+H+=Li++H2OBe+2NaOH=Na2BeO2+H2↑NH4++OH﹣=NH3+H2O
LiOH+H+=Li++H2OBe+2NaOH=Na2BeO2+H2↑NH4++OH﹣=NH3+H2O
【解析】
由元素在周期表中的相对位置可知:①是H、②是Li、③是Be、④是C、⑤是N、⑥是O、⑦是F、⑧是Na、⑨是S、⑩是Cl。自然界物质种类最多的元素应为碳元素;根据离子的电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小判断;由⑥、⑧、⑩元素形成的一种离子化合物为次氯酸钠,在次氯酸钠中钠离子与次氯酸根离子之间是离子键,次氯酸根离子内部有一个共价键;根据斜线性质相似规则,Li的最高价氧化物对应的水化物的性质与氢氧化镁相似;Be的氧化物,氢氧化物有两性,Be单质与氢氧化钠反应生成铍酸钠和水;已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,应该为铵根离子与氢氧根离子的反应。
由元素在周期表中的相对位置可知:①是H、②是Li、③是Be、④是C、⑤是N、⑥是O、⑦是F、⑧是Na、⑨是S、⑩是Cl。
(1)自然界物质种类最多的元素应为碳元素,位于周期表中第二周期第IV族,故答案为:第二周期第IV族;
(2)根据离子的电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小判断,所以⑧⑨⑩的离子半径由大到小的顺序为S2﹣>Cl﹣>Na+,故答案为:S2﹣>Cl﹣>Na+;
(3)由⑥、⑧、⑩元素形成的一种离子化合物为次氯酸钠,在次氯酸钠中钠离子与次氯酸根离子之间是离子键,次氯酸根离子内部有一个共价键,其电子式为,故答案为:LiOH+H+=Li++H2O;
(4)根据斜线性质相似规则,Li的最高价氧化物对应的水化物的性质与氢氧化镁相似,与盐酸反应的离子方程式为Be+2OH﹣=BeO22﹣+H2↑,故答案为:Be+2OH﹣=BeO22﹣+H2↑;
(5)Be的氧化物,氢氧化物有两性,Be单质与氢氧化钠反应生成铍酸钠和氢气,与铝相似,反应的离子方程式为Be+2OH﹣=BeO22﹣+H2↑,故答案为:Be+2OH﹣=BeO22﹣+H2↑;
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,应该为铵根离子与氢氧根离子的反应,该反应式为NH4++OH﹣=NH3+H2O,故答案为:NH4++OH﹣=NH3+H2O。

 名校课堂系列答案
名校课堂系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__________min(填0~1、1~2、2~3、3~4、4~5),原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(_________)
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
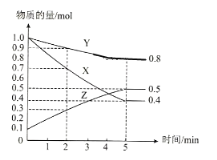
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A X、Y、Z的反应速率相等
B X、Y的反应速率比为3:1
C 容器内气体压强保持不变
D 生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:__________。
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
