题目内容
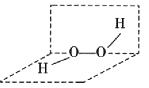
【题目】均由两种短周期元素组成的A、B、C三种化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4。A和C分子中,其原子个数比都为1:1,B分子中原子个数比为1:2。由两种短周期元素组成的双核D离子中含有10个电子,它与A、B分子均能反应,生成一种常见的10电子分子E。请回答下列问题:
(1)C的化学式为_____。A的还原性______B的还原性(填“大于”或“小于”)
(2)写出B与D在溶液中反应的离子方程式__________。
(3)气态的A分子遇到某10电子分子会产生白烟,请写出该白烟成分的电子式_______;该白烟的水溶液与浓的含D离子的溶液在受热条件下反应的离子方程式为_________。
(4)写出一个含有18电子的五原子分子的化学式_______,其中的一种元素形成的单质可被含D离子的溶液腐蚀,发生反应的离子方程式为____________。
【答案】H2O2 小于 H2S + OH- = HS- + H2O 或HS- + OH- = S2- + H2O  OH-+NH4+
OH-+NH4+![]() H2O+NH3↑ SiH4 Si + 2OH- + H2O = SiO32- + 2H2↑
H2O+NH3↑ SiH4 Si + 2OH- + H2O = SiO32- + 2H2↑
【解析】
A、B、C三种由两种短周期元素组成的化合物分子所含原子的数目依次为2、3、4,且都含有18个电子,A、C分子中两种原子的个数比均为1:1,则A是HCl,C是H2O2,B分子中的原子个数比为1:2,则B是H2S,由两种短周期元素组成的双核D离子中含有10个电子,它与HCl和H2S分子均能反应,则生成一种常见的10电子分子E,则E为水,逆分析法可知,该双核D离子为OH-,据此解答。
根据上述分析可知,A、B和C分别是HCl和H2S和H2O2,E为H2O,则
(1)C为H2O2,因氯气的氧化性大于硫单质,则离子的还原性比较:HCl小于H2S,
故答案为:H2O2;小于;
(2)H2S为弱酸,与氢氧根离子反应生成硫氢根离子或硫离子,对应的离子方程式为:H2S + OH- = HS- + H2O 或HS- + OH- = S2- + H2O,
故答案为:H2S + OH- = HS- + H2O 或HS- + OH- = S2- + H2O;
(3)HCl与氨气产生大量白烟,形成氯化铵,氯化铵为离子化合物,其电子式为: ,氯化铵与浓的含OH-的溶液在受热条件下反应生成氨气和水,其离子方程式为OH-+NH4+
,氯化铵与浓的含OH-的溶液在受热条件下反应生成氨气和水,其离子方程式为OH-+NH4+![]() H2O+NH3↑,
H2O+NH3↑,
故答案为: ;OH-+NH4+
;OH-+NH4+![]() H2O+NH3↑;
H2O+NH3↑;
(4)含有18电子的五原子分子中的一种元素形成的单质可被含OH-的溶液腐蚀,则该分子为SiH4,其中硅单质可与OH-反应,其离子方程式为:Si + 2OH- + H2O = SiO32- + 2H2↑,
故答案为:SiH4;Si + 2OH- + H2O = SiO32- + 2H2↑。

【题目】下表为元素周期表的一部分,请参照元素①﹣⑩在表中的位置,回答下列问题:
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)自然界物质种类最多的元素在周期表中的位置是______
(2)⑧⑨⑩的离子半径由大到小的顺序为______(填化学用语).
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式______
(4)根据斜线性质相似规则,②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,写出该反应的离子方程式______.