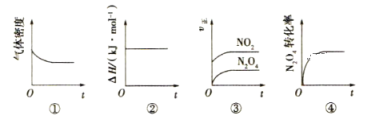
��Ŀ����
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯,��400mLϡ�����м���������п��,����ˮ�������ռ���Ӧ�ų�������,ʵ���¼���(�ۼ�ֵ):
ʱ��(min) | 1 | 2 | 3 | 4 | 5 |
�������(mL)(��״��) | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������__________min(��0~1��1~2��2~3��3~4��4~5),ԭ����__________��
����3~4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����__________(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ����������,�������������м���������������Һ�Լ�����Ӧ����,����Ϊ�����е�����_________��
A.����ˮ B.KCl��Һ C.KNO3��Һ D.CuSO4��Һ
(3)ij�¶�����4L�ܱ�������,X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ
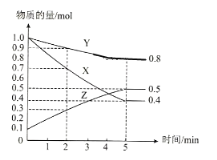
���÷�Ӧ�Ļ�ѧ����ʽ��__________��
���÷�Ӧ�ﵽƽ��״̬�ı�־��__________��
A X��Y��Z�ķ�Ӧ�������
B X��Y�ķ�Ӧ���ʱ�Ϊ3:1
C ����������ѹǿ���ֲ���
D ����1mol Y��ͬʱ����2mol Z
��2min��X��ת����Ϊ__________��
����������Ӧ��X��Y��Z�ֱ�ΪH2��N2��NH3,����֪17g�����ֽ�ɵ���������Ҫ����46kJ����,��÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ:__________��
���𰸡�2~3min ��÷�Ӧ�Ƿ��ȷ�Ӧ,��ʱ�¶ȸ�������Ũ�Ƚϴ�,���Է�Ӧ���ʽϿ� 0.025mol/(L��min) CD 3X(g)+Y(g) ![]() 2Z(g) CD 30% N2(g)+3H2(g)
2Z(g) CD 30% N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92kJ/mol;
2NH3(g) ��H=-92kJ/mol;
��������
��1������0��1��1��2��2��3��3��4��4��5minʱ����У��������������ֱ�Ϊ100mL��140mL��224mL��112mL��54mL�������������Խ���ʱ��Σ���Ӧ����Խ����¶ȡ�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�������
�ڼ�������������������2HCl��H2������������������ʵ���������Ũ�ȵı仯������v=��c/��t���㷴Ӧ���ʣ�
��2��Ϊ�˼�����Ӧ���ʵ������ٲ��������������ɽ���H+Ũ�ȣ�������Ӱ��H+�����ʵ�����
��3���ٸ��ݲμӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮����д��ѧ����ʽ��
�ڷ�Ӧ����ƽ��״̬ʱ�����淴Ӧ������ȣ�ͬ�����ʣ������淴Ӧ����֮�ȵ���ϵ��֮�ȣ���ͬ���ʣ���ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯�����ɴ˽����жϣ�
��ת����=![]() ��100%��
��100%��
��17g���������ʵ�����1mol��1mol�����ֽ�����46kJ������������1mol�����ų�46kJ����������2mol�����ų�92kJ������
��1������0��1��1��2��2��3��3��4��4��5minʱ����У��������������ֱ�Ϊ100mL��140mL��224mL��112mL��54mL���ɴ˿�֪��Ӧ��������ʱ���Ϊ2��3min��ԭ���ǣ��÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ����Խ�ʴ�Ϊ��2��3min����÷�Ӧ�Ƿ��ȷ�Ӧ����ʱ�¶ȸ�������Ũ�Ƚϴ����Է�Ӧ���ʽϿ졣
����3��4minʱ����ڣ�n��H2��=0.112L��22.4L/mol=0.005mol������2HCl��H2������������������ʵ���Ϊ0.01mol��������HCl��=0.01mol��0.4L��1min=0.025mol/��Lmin�����ʴ�Ϊ��0.025mol/��Lmin����
��A.��������ˮ��H+Ũ�ȼ�С����Ӧ���ʼ�С�Ҳ����ٲ���������������A��ȷ��
B.����KCl��Һ��H+Ũ�ȼ�С����Ӧ���ʼ�С�Ҳ����ٲ���������������B��ȷ��
C.����KNO3��Һ��H+Ũ�ȼ�С����������Һ����NO3-������ǿ�����ԣ���Zn��Ӧ���������ɣ���C����
D.����CuSO4��Һ��Zn�û���Cu��Ӧ�ٶ�������Ӱ������������������D����
�ʴ�Ϊ��CD��
��2������ͼ����Կ�������Ӧ��X��Y�����ʵ������٣�ӦΪ��Ӧ�Z�����ʵ������࣬ӦΪ���������Ӧ���е�5minʱ����n��Y��=0.2mol����n��Z��=0.4mol����n��X��=0.6mol��
����n��Y������n��Z������n��X��=1��2��3���μӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ�ķ���ʽΪ��3X+Y![]() 2Z���ʴ�Ϊ��3X+Y
2Z���ʴ�Ϊ��3X+Y![]() 2Z��
2Z��
��A.ƽ��ʱX��Y��Z�ķ�Ӧ���ʿ�����ȣ�������ʵ���ʼ����ת�����йأ���������ƽ��״̬�ı�־����A����
B.���ŷ�Ӧ�Ľ���X��Y�ķ�Ӧ���ʱ�ʼ��Ϊ3��1��������Ϊƽ��״̬�ı�־����B����
C.����̶����������������ʵ�����ȷ������������ѹǿ����һ����˵�����淴Ӧ������ȣ���ƽ��״̬����C��ȷ��
D.����1molY��ͬʱ����2molZ��ͬʱ����2molZ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
�ʴ�Ϊ��CD��
��2min��X��ת����=![]() ��100%=
��100%=![]() ��100%=30%���ʴ�Ϊ��30%��
��100%=30%���ʴ�Ϊ��30%��
��![]() 2NH3��g����H=-92kJ/mol���ʴ�Ϊ��N2��g��+3H2��g��
2NH3��g����H=-92kJ/mol���ʴ�Ϊ��N2��g��+3H2��g��![]() 2NH3��g����H=-92kJ/mol��
2NH3��g����H=-92kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ������ڱ��е�λ�ã��ش��������⣺
IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
1 | �� | |||||||
2 | �� | �� | �� | �� | �� | �� | ||
3 | �� | �� | �� |
(1)��Ȼ��������������Ԫ�������ڱ��е�λ����______
(2)��������Ӱ뾶�ɴ�С��˳��Ϊ______���ѧ�����
(3)д���ɢ���������Ԫ���γɵ�һ�����ӻ�����ĵ���ʽ______
(4)����б���������ƹ��ڵ�����������Ӧ��ˮ���������ᷴӦ�����ӷ���ʽ____________
(6)��֪W+X=Y+Z��W��X��Y��Z�ֱ����ɢ٢ݢ�����Ԫ���γɵ�����ʮ�������ӣ�д���÷�Ӧ�����ӷ���ʽ______��