题目内容
氢氧燃料电池是将多孔镍电极放置在KOH溶液中,然后分别向两极通入H2和O2,即可产生电流.下列叙述中正确的是( )
| A.通入H2的电极为正极 |
| B.正极的电极反应式为O2+2H2O+4e-=4OH- |
| C.工作时,负极区溶液pH增大 |
| D.工作时,溶液中的阴离子移向正极 |
A.燃料电池中,通入氧气的一极为正极,通氢气的电极是负极,故A错误;
B.正极发生还原反应,电极方程式为02+2H2O+4e-=40H-,故B正确;
C.负极反应为:2H2-4e-+4OH-=2H2O,消耗氢氧根离子,所以负极区溶液pH减小,故C错误;
D.放电时,溶液中的阴离子向负极移动,故D错误;
故选B.
B.正极发生还原反应,电极方程式为02+2H2O+4e-=40H-,故B正确;
C.负极反应为:2H2-4e-+4OH-=2H2O,消耗氢氧根离子,所以负极区溶液pH减小,故C错误;
D.放电时,溶液中的阴离子向负极移动,故D错误;
故选B.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
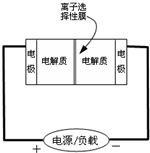
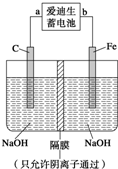
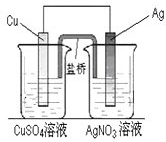
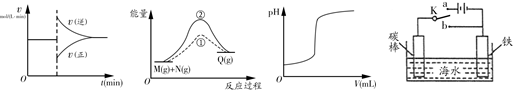
 2AB3(g)的ΔH<0
2AB3(g)的ΔH<0 CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。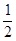 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol; H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题: