题目内容
有关下列图象的说法正确的是
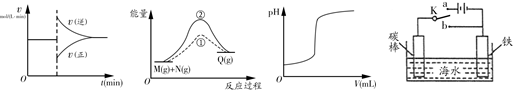
甲 乙 丙 丁

甲 乙 丙 丁
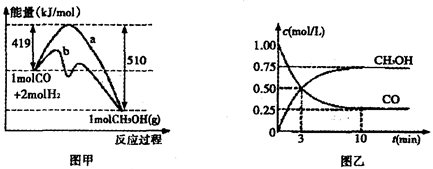
| A.图甲中的曲线可以表示某化学平衡体系改变温度后反应速率随时间的变化 |
| B.图乙中①、②曲线分别表示反应M(g)+N(g)→Q(g)ΔH >0使用和未使用催化剂时,反应过程中的能量变化 |
| C.图丙中的曲线可表示向一定量的氢氧化钠溶液中滴加一定浓度盐酸时的pH变化 |
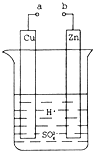
| D.图丁中开关K置于a或b处均可减缓铁的腐蚀 |
B
试题分析:A.若某化学平衡体系改变温度,则V正、V逆都要增大或减小。错误。B.由于使用催化剂能降低反应的活化能,使反应在较低的温度下就可以发生,因此反应速率大大加快。但是催化剂不能改变反应物、生成物的能量,所以不能改变化学反应的反应热。正确。C.NaOH溶液是碱性溶液,当向其中滴加HCl时,溶液的pH会逐渐减小,当二者恰好反应时,溶液的pH会发生大的突越。随后溶液逐渐变为酸性溶液,pH逐渐减小。错误。D.图丁中开关K置于a处,该装置为电解池,Fe作阴极,在阴极上发生还原反应,可减缓铁的腐蚀;若开关K置于b处,该装置为原电池,Fe作负极,失去电子而被氧化,可大大加快铁的腐蚀。错误。

练习册系列答案
相关题目
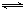 2NO(g) △H= 。
2NO(g) △H= 。
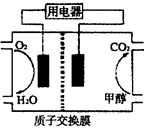
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。 H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。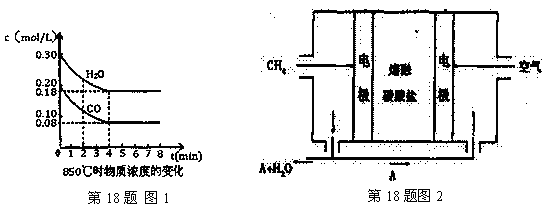
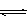 CH3OH(g)
CH3OH(g)