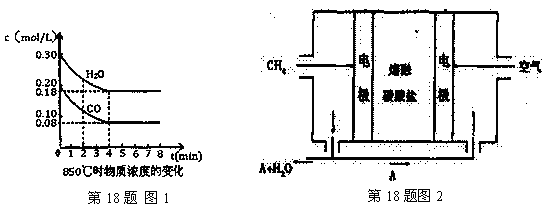
题目内容
某电池的总反应的离子方程式为2Fe3++ Fe = 3Fe2+,不能实现该反应的原电池是( )
正极 负极 电解质溶液
正极 负极 电解质溶液
| A.Cu Fe FeCl3 |
| B.C Fe Fe(NO3)3 |
| C.Fe Zn Fe2(SO4)3 |
| D.Ag Fe CuSO4 |
CD
能实现该反应的原电池必须满足:①电解质溶液含有Fe3+,②负极材料为Fe,③正极材料比Fe的活泼性弱且能导电的物质。则C与D不能满足这三个条件。

练习册系列答案
相关题目
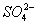
 2PbSO4+2H2O,则下列说法正确的是( )
2PbSO4+2H2O,则下列说法正确的是( ) 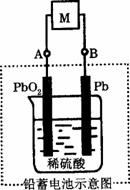
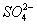 ====PbSO4
====PbSO4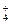 ===Zn2++Mn2O3+2NH3+H2O
===Zn2++Mn2O3+2NH3+H2O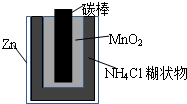
 H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。